高一年级化学下期期中试卷
高一年级 化学
(时间:90分钟,满分:110分)
注:可能用到的相对原子质量:
H-1,O-16,C-12,N-14,S-32,Cu-64,Na-23,Fe-56
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1、现有以下几种措施:①对硫酸工业产生的尾气进行吸收处理,②对煤进行脱硫处理,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施的
A.①②③ B.②③④ C.①②④ D.①②③④
2、医疗上使用放射性核素 ![]() 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
A.19 B.53 C.72 D.125
3、下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2、D2 D.24Mg和24Na
4、下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
5、下列离子中,电子数大于质子数且质子数大于中子数的是
A. D3O+ B. Li+ C. OD¯ D. OH¯
6、下列不能用浓硫酸来干燥的气体是
A.HCl B.HI C.SO2 D.Cl2
7、下列各组物质中化学键的类型相同的是
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. CaCl2 NaOH H2O D. NH3 H2O CO2
8、下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是
A.SO2 B.Na2O2 C.O3 D.新制氯水
9、原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有
A.1种 B.2种 C.3种 D.4种
10、下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
11、下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
12、能够说明硫的非金属性比氯弱的事实有:
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态。
A.①③ B.①②③ C.②④ D.①②③④
13、下列说法不正确的是
A.硫既可作氧化剂,也可作还原剂
B.硫酸铜晶体中加入浓硫酸,蓝色晶体变为白色粉末,是因为浓硫酸具有脱水性
C.可用铁罐贮运冷的浓硫酸
D.医药上常用硫酸钡作X射线透视肠胃的内服药剂
14、科技报道:美国夏威夷联合天文台中心的科学家发现了新的氢微粒。这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考。对于这种氢微粒,下列说法错误的是
A.可以推测它的化学性质与H2不同 B.它比普通氢分子多一个氢原子核
C.它的组成可以用H3+表示 D.它一定含有3个中子
15、钋是原子序数最大的氧族元素,下列有关钋及钋的化合物的推测错误的是
A.钋是第84号元素 B.钋是能导电的固体
C.钋的氢化物很稳定 D.钋可能有两种不同价态的氧化物
16、对于X—O—H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是
A. X—O—H的水溶液不能导电
B.当X是金属性很强的元素时,X—O—H一定是强碱
C. X—O—H一定是离子化合物
D. X—O—H一定是共价化合物
17、A、B两种原子,A的M层比B的M层少3个电子,B的L层电子数恰为A 的L层电子数的2倍。A和 B分别是
A. 硅原子和钠原子 B. 硼原子和氦原子
C. 氯原子和碳原子 D. 碳原子和铝原子
18、含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,问生产98 %的硫酸1吨,需黄铁矿多少吨
A. 0.742吨 B. 0.85吨 C. 0.845吨 D. 1.484吨
19、石膏[CaSO4·2H2O]加热到150~170℃时,会失去部分结晶水而生成熟石膏
[2CaSO4·H2O],则通过加热每生成1摩熟石膏失去水的物质的量为
A.1摩 B.1.5摩 C.2摩 D.3摩
20、向100毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还
原的H2SO4的物质的量
A.小于0.9摩 B.等于0.9摩
C.在0.9摩与1.8摩之间 D.大于1.8摩
二、填空题(本题共40分)
21、(6分)(1)臭氧的化学式为 ,它和氧气的关系是
(2)用双氧水制取氧气的反应方程式
(3)C与浓硫酸反应的化学方程式
22、(6分)某工厂排出的废水中含有氯气,为了除去废水中的游离态氯,且使废水变为中性,有人提出如下图所示的方案:在废水排出管的A、B处分别注入一定量的烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液反应如下:
Cl2 + Na2SO3 + H2O = Na2SO4 + 2HCl
![]()
![]() A
B
A
B
![]()
![]()
![]()
![]()
![]()
![]()
![]() 废
废
![]() 水
水![]()
试写出:
(1)A、B处应加入的物质的化学式依次为 、 。
(2)A、B处发生的反应的离子方程式是 、
。
23、(8分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):____,理由是 ;
(2)Y是________,Z是__________,W是__________;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1,
写出该化合物的化学式_____________。
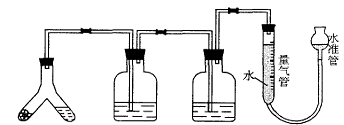 |
24、(20分)某课外兴趣小组为了探究某白色固体M的成分(可能为Al粉、Na2SO3、Na2SO4、Na2CO3中的一种或多种,设计了如下图装置。
固体M 稀硫酸 酸性KMnO4 溶液 浓NaOH溶液
A B C
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置中溶液紫色变浅并增重,C装置增重,反应后进入量气管气体的体积为VmL。
由上述实验事实可知:
(1)固体M中一定有的物质是 (填化学式)
(2) B、C装置的名称是 。
写出C装置中发生的反应的离子方程式 。
(3)量气管中的气体为 ,理由是 。
写出此气体生成的离子方程式_____________________________________。
(4)固体M中不能确定是否存在的物质是______________(填化学式)。
如果想进一步确定此种物质是否存在,有同学提出实验完毕后,拆下仪器A,向其中加入BaCl2,观察是否生成沉淀即可证明,你认为可行吗? ,理由是
。如果答不行,请你提出改进方案:
。(如果答行,此空不填)
高一年级化学下期期中试卷
| 座号 | 总分 |
高一化学答题卷
一、选择题(本题共40分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
二、填空题(本题共40分)
21、(1) ,
(2)
(3)
22、(1) 、 。
(2) 、 。
23、(1) , ;
(2) , , (3) 。
24、(1) (填化学式)
(2) 。 。
(3) , 。
。
(4) (填化学式)。 , 。
。(如果答行,此空不填)
三、推断题(本题共22分)
25、下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
| ③ | ④ | ⑤ | |||||||||||||||
| ① | |||||||||||||||||
| ② | |||||||||||||||||
(1)请在上表中用实线补全元素周期表边界。
(2)元素②与⑤形成的化合物的电子式为 。元素③氢化物的结构式为 。
元素①的单质、元素②的单质都和水反应,现象更为剧烈的是 。
元素④一般在化合物中显 价,但若能与 形成化合物,所显示的价态则恰好相反。(此题涉及到①②③④⑤时用对应的元素符号表示)
(3)元素A、B都是短周期元素,元素A与④同主族,元素A与B同周期,而且B的最外层电子数与电子层数相同,请在上方元素周期表中标明元素A、B的位置(用对应的元素符号表示)。
比较B原子半径与A原子半径: > (用对应的元素符号表示)。
比较A、B的最高价氧化物水化物的酸性强弱为: > (用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的 ,请写出元素在元素周期表中的位置与元素原子结构的关系: 。
四、计算题(本题共8分)
26、用18.4mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,所得SO42-离子浓度为2.68mol/L,
求(1)反应所得气体在标准状况下的体积, (2)溶液中CuSO4的物质的量浓度。
高一化学答案
一、选择题(每小题只有一个正确答案,每小题2分,本题共40分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | A | C | D | B | D | A | B | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | B | D | C | B | D | A | D | A |
二、填空题(本题共40分)
21、(1) O3 、同素异形体
(2) 2H2O2 = 2 H2O + O2↑(用MnO2做催化剂)
(3) C+ 2H2SO4(浓)=CO2 ↑+ 2SO2↑+ 2H2O (条件:加热)
22、(1)Na2SO3 、NaOH (2)Cl2 + SO32- + H2O = SO42- +2 H++2Cl- 、 H+ + OH- = H2O
23、(1)否,若三者处于同一周期,则最外层电子数之和不可能为17。
(2)N,O,S (3)(NH4)2SO4
24、(1)Al、Na2SO3 、Na2CO3 (2)洗气瓶; 2OH-+CO2 = 2H2O+CO32-
(3)H2; SO2 、CO2 在B、C装置中已经吸收,而且H2难溶于水,
2Al+6H+=2Al3++3H2 ↑
(4) Na2SO4 ;不可行; Na2SO3 、Na2CO3与稀硫酸反应可以生成Na2SO4;
将装置A中的稀硫酸换为稀盐酸。
三、推断题(本题共22分)
25、(1)
| ③ | ④ | ⑤ | |||||||||||||||
| ① | Al | S | |||||||||||||||
| ② | |||||||||||||||||
(2)KF的电子式,NH3的结构式,K,负,F
(3)在元素周期表中填写Al、S的位置,Al>S,H2SO4> Al(OH)3
(4)周期性变化; 元素的周期数即为原子的电子层数,元素的主族序数即为原子结构的最外层电子数。
四、计算题(本题共8分)
26、(1)2.24L (2) 1mol/ L