高一年级化学教学质量检测试题
化学试题卷
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,上交试题卷和答题卷。
可能用到的相对原子质量: H -1 Na -23 C-12 O- 16 Cl-35.5 S-32 Fe-56
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.日常生活中使用的植物油属于哪类物质
A.烃类 B.蛋白质 C.酯类 D.高分子
2.根据主族元素的原子序数,下列有关该元素的原子各项不能确定的是
A.质子数 B.中子数 C.最外层电子数 D.最高正化合价
3.同素异形现象是指
A.相同元素的相同个数的原子可形成不同的化合物
B.相同元素的原子可形成不同外形的物质
C.同一元素能够形成几种不同的单质
D.同一元素形成的单质可有几种不同的聚集状态
4.下列观点中,错误的是
A.化学反应既能实现物质的转化、又能实现能量的转化
B.分子是保持物质化学性质的一种粒子
C.构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等
D.储存在物质中的化学能在化学反应前后是不变的
5.加成反应是有机化学中的一类重要的反应,下列过程中发生加成反应的是
A.甲烷与氯气混和后光照条件下发生反应
B.乙烯通入溴的四氯化碳溶液发生反应
C.乙烯通入酸性高锰酸钾溶液后溶液褪色
D.在苯中滴入溴水,振荡后溴水层颜色变浅
6.新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,这说明镁合金具有的优异性能是
①熔点低 ②硬度大 ③延展性好 ④导电性强 ⑤密度小 ⑥耐腐蚀
A.①②③ B.②③④ C.①③⑥ D.②⑤⑥
7.下列属于非均匀混合物的分散系是
A.铁粉和硫粉经充分研磨 B.酒精和水经充分搅拌
C.氢氧化铁胶体 D.CO2和H2混合后长时间放置
8.以下说法正确的是
A.1 mol O的质量为16 g B.1 mol 氢的质量为1 g
C.1 mol C的质量为12 g/mol D.1 mol氮的质量为 28 g/mol
9.某粒子用符号![]() M
M![]() 表示,下列关于该粒子的叙述中,正确的是
表示,下列关于该粒子的叙述中,正确的是
A.所含质子数为(A-n) B.所含中子数为(A-Z-n)
C.所含电子数为(Z+n) D.中子数—电子数=A-2Z+n
10.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量较低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
11.以下元素的原子半径大小关系不正确的是(X表示原子,其左下标为相应的核电荷数)
A.4X > 5X B. 9X > 11X C. 3X > 1X D. 15X > 17X
12.以下对元素的性质判断正确的是
A.元素的最高价氧化物的水化物碱性越强,该元素的金属性就越强
B.元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强
C.元素的单质和水的反应越剧烈,该元素的非金属性就越强
D.元素的单质越容易和氢气化合,该元素的金属性就越强
13.某主族元素R的原子其电子式可用下式表示:![]() 。该元素组成的以下物质,其分子式肯定错误的是
。该元素组成的以下物质,其分子式肯定错误的是
A.最高价氧化物分子式为R2O5 B.含氧酸分子式为 HRO3
C.含氧酸分子式为H3RO4 D.气态氢化物分子式为RH5
14.以下关于元素周期表的结构叙述正确的是
A.元素周期表有七个主族,八个副族
B.元素周期表有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.第三主族位于元素周期表的第三列(从左往右)
D.零族位于元素周期表的第18列(从左往右)
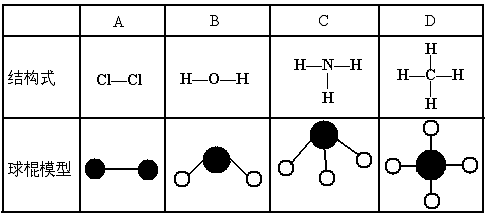
15.下表中四种物质的结构式或球棍模型有错误的是
16.不能用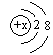 来表示其结构的微粒是
来表示其结构的微粒是
A.Ne B.F- C.Al3+ D.S2-
17.在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g) 测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g) 测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
A.O2为0.15mol∙L-1 B.SO2为0.25mol∙L-1
C.SO3为0.4mol∙L-1 D.O2、SO3的浓度相等
18.用石墨作电极电解滴有酚酞的饱和食盐水,下列说法正确的是( )
A.阳极上产生氢气 B.阴极上产生氯气
C.阴极附近溶液呈红色 D.溶液中的阳离子向阳极移动
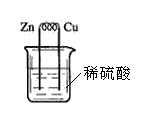 19.如右图所示是铜、锌、稀硫酸形成原电池的装置图,下列有关说法中错误的是
19.如右图所示是铜、锌、稀硫酸形成原电池的装置图,下列有关说法中错误的是
A.锌是负极,锌失去电子形成Zn2+进入溶液
B.电子从锌极经导线流向铜极
C.溶液中H+流向正极,正极附近H+浓度会明显增大
D.铜是正极,流入铜电极的电子使H+还原成H2
20.现代城市空气污染物之一NO主要来源于汽车尾气,汽车尾气中产生NO的原因是
A.汽车燃料油(如汽油、柴油)中含氮,NO是其燃烧产物
B.是空气中的N2和汽车燃料油发生了化学反应
C.是汽车排出的高温尾气导致空气中的N2和O2发生化合反应
D.空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物
二、简答题(本大题共5小题,共28分)
21.(5分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50 mL密度为1.1g∙cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
(1)实验时放出气体的总体积为_____▲____;
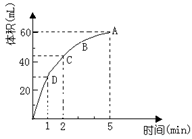 (2)放出一半气体所需要的时间为____▲___;
(2)放出一半气体所需要的时间为____▲___;
(3)ABCD四点化学反应速率的由快到慢顺序为_▲_;
(4)以上反应速率的大小变化的原因是____▲___;
(5)在5min后,收集到的气体体积不再增加,原因是____▲___。
22.(4分)A、B、C、D四种元素均为短周期元素,其原子半径依次减小,它们的气态氢化物分子所含的电子数相同,C元素原子的K层电子数与M层电子数之和等于L层电子数。根据以上信息,按要求写出以下化学式(用A、B、C、D所代表的真实元素符号表示)。
(1)A的最高价氧化物 ▲ ;(2)B的气态氢化物 ▲ ;
(3)C的最高价的水化物 ▲ ;(4)D的单质 ▲ 。
23.(6分)取一支洁净试管,向试管中加入0.1mol·L-1AgNO3溶液2 mL,再向硝酸银溶液中加入稍过量的铜粉,反应足够长时间后,取上层清液于另一支试管中,再向该试管中滴加0.1 mol·L-1KI溶液。回答有关上述实验的下列问题:
(1)可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是 ▲ 。
(2)可判断硝酸银溶液和铜的反应的逆反应也同时发生的现象是 ▲ 。
(3)实验中若将KI溶液换成KCl溶液,则可能出现什么不同的现象?
▲ 。
24.(6分)热值指在一定条件下每克物质完全燃烧所放出的热量,(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。
| 物质 | H2 | CO | CH4 |
| 热值/kJ·g–1 | 143 | 10 | 56 |
(1)根据以上热值数据,最理想的燃料是 ▲ 。
(2)根据以上热值数据,写出在该状态下氢气燃烧的热化学方程式 ▲ 。
(3)若管道煤气(含体积比为1:1的H2和CO)价格为1.00元/m3,天然气的价格为2.50元/m3,使用哪种气体在经济上更为合算? ▲ 理由是 ▲ 。
25.(7分)下图为某工厂处理含Fe3+、Cu2+、Ag+废水的流程图
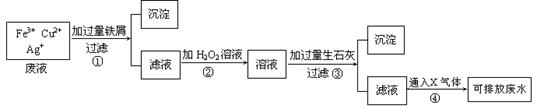
据图回答下列问题:
(1)操作①中发生反应的离子方程式为 ▲ 。
(2)操作②中H2O2起了 ▲ 剂(填“氧化”或“还原”)的作用。
(3)操作③中产生的沉淀为 ▲ (填化学式)。
(4)操作④中通入的X气体为 ▲ (填化学式)
 三、实验题(本大题共3小题,共20分)
三、实验题(本大题共3小题,共20分)
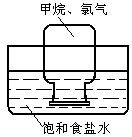
26.(4分)如右图所示,集气瓶内装有4/5的氯气和1/5的甲烷气体,将该装置在紫外光或漫射光的照射下,会出现什么现象?这些现象说明了什么?请仿照示例填写下表:
| 出现的现象 | 说明了什么 | |
| 示例 | 瓶内黄绿色渐褪 | 氯气和甲烷发生了化学反应 |
| 回答(1) | ▲ | ▲ |
| 回答(2) | ▲ | ▲ |
27.(10分)将黄豆大小的不规则形状的两粒金属钠分别投入盛有少量水和乙醇的两个烧杯中,观察两烧杯中的现象,根据观察到的部分现象,填写下表(表内打“√”或“×”)
| 观察到的现象 | 钠投入水中 | 钠投入乙醇中 |
| (1)有气体产生 | ▲ | ▲ |
| (2)金属钠熔成小球状 | ▲ | ▲ |
| (3)金属钠浮于液面上 | ▲ | ▲ |
| (4)金属钠沉于液面下 | ▲ | ▲ |
对上表中水、乙醇中出现的相同现象加以解释: ▲
▲
▲ 。
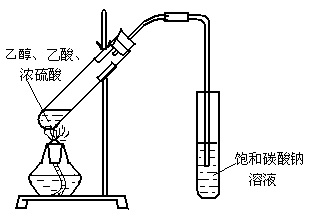 28.(6分)某实验小组用下图装置制取乙酸乙酯,请回答下列问题:
28.(6分)某实验小组用下图装置制取乙酸乙酯,请回答下列问题:
(1)该装置有一处错误,请指出错误 ▲ ;并说出该错误可能引起的后果是
▲ 。
(2)能证明该实验有新物质(乙酸乙酯)生成最明显和直接的现象是 ▲ 。
(3)写出该反应的化学方程式 ▲ 。
四、计算题(本大题共2小题,共12分)
29.(6分)有100毫升 12 mol·L-1的盐酸溶液。求:
(1)该溶液中氢离子的物质的量浓度为__▲__mol∙L-1。
(2)该溶液中相当于溶解了标准状况下__▲__L的HCl气体。
30.(6分)将0.6g某种铁的硫化物在氧气中灼烧,使硫全部氧化为二氧化硫,再将所得二氧化硫全部氧化为三氧化硫,三氧化硫与水反应完全转化为硫酸。这些硫酸恰好与40mL 0.5mol∙L-1氢氧化钠溶液完全中和生成正盐。
(1)求0.6g这种铁的硫化物中硫的物质的量。(列式计算)
(2)求铁的硫化物的化学式。(列式计算)