高一化学第一学期阶段学习认证卷
高一化学试题
(试题范围:鲁科版必修Ⅰ第一章)
本试卷分第Ⅰ卷(选择题 共50分)和第Ⅱ卷(非选择题 共50分)两部分。考试时间为90分钟。满分为100分。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第Ⅰ卷(选择题 共50分)
注意事项:
1.答第Ⅰ卷前,考生务必将密封线内的项目填写清楚。
2.每小题选出答案后,填入第Ⅰ卷答题栏中。
3.考试结束,考生只将第Ⅱ卷交回,第Ⅰ卷自己保留。
一、选择题(每题只有一个选项符合题意。每题2分,共20分)
 1.用如图所示的方法研究某气体的性质,这种方法属于
1.用如图所示的方法研究某气体的性质,这种方法属于
A.实验法 B.观察法
C.分类法 D.比较法
2.关于钠的叙述中,正确的是
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
3.实验室要用固体氯化钠试剂准确配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的
A.500 mL容量瓶 B.胶头滴管
C.试管 D.托盘天平
4.下列各组中的两种物质相互作用时,若改变反应条件或改变它们的用量,对生成物种类没有影响的是
A.Na2O2与CO2 B.Ca(OH)2与CO2
C.Na与O2 D.C与O2
5.下列关于氯气的叙述,不正确的是
A.氯气是一种有毒的气体
B.氯气、氯水、液氯是同一种物质
C.氯气能与水发生反应
D.氯气是一种黄绿色,有刺激性气味的气体
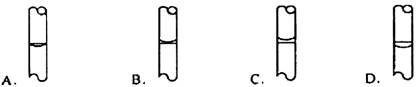
6.在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是
7.在研究金属钠与水的反应实验中,反应过程中所观察到的实验现象与金属钠的下列性质无关的是
A.熔点低 B.密度小
C.硬度小 D.化学性质活泼
8.市售“84”消毒液的主要成分是
A.HClO B.Ca(ClO)2
C.H2O2 D.NaClO
9.油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充入某种气体防止食品被直接挤压,你认为下列气体中不宜充入包装袋的是
A.氮气 B.空气
C.氯气 D.氩气
10.提出原子学说,为近代化学的发展奠定了坚实的基础的科学家是
A.波义耳 B.拉瓦锡
C.道尔顿 D.门捷列夫
二、选择题(每题只有一个选项符合题意。每小题3分,共30分)
11.将钠和碳分别置于下图所示的两个盛满氧气的集气瓶中燃烧完毕后,打开装置中的两个活塞,这时观察到
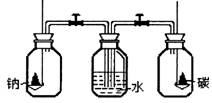
A.水进入左瓶
B.水进入右瓶
C.水同时进入两瓶
D.水不进入任何一瓶
12.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的NH![]() 离子中含有的电子数为10NA
离子中含有的电子数为10NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
13.摩尔是
A.物质的质量单位
B.物质的量
C.物质的量的单位
D.就是6.02×1023个微粒
14.实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A.①②③④ B.②③④⑥⑨
C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
15.设NA代表阿伏加德罗常数,下列说法正确的是
A.22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA
B.含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA
C.常温常压下,32 g O2和32 g O3所含氧原子数都是2NA
D.标准状况下,11.2 L H2O含有0.5NA分子
16.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是
A.![]() L B.
L B.![]()
C.![]() L
D.
L
D.![]() L
L
17.在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中,不正确的是
A.该溶液的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
18.A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A.10 mL 5mol·L-1的Al溶液加水配制成100 mL溶液
B.9.2 g B物质(式量为46)溶于水配成100 mL溶液
C.1.806×1023个C的分子溶于水配成100 mL溶液
D.0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
19.将一小块钠投入盛5 mL饱和澄清石灰水的试管里,不可能观察到的现象应是
A.钠熔成小球浮在液面四处游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
20.同温同压下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该化合物的化学式为
A.XY3 B.XY C.X3Y D.X2Y3
绝密★启用前
高一化学第一学期阶段学习认证卷
高一化学试题
(试题范围:鲁科版必修Ⅰ第一章)
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| 答案 |
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | ||
| 答案 |
第Ⅱ卷(非选择题共50分)
注意事项:
1.用钢笔或圆珠笔将答案直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 得分 | 评卷人 |
三、(本题共18分)
21.(10分)某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
完成下列问题:
(1)钾的原子核外有19个电子,画出钾的原子结构示意图_______________。
(2)预测钾的化学性质,完成下列反应的化学方程式。
①钾在氯气中燃烧_____________________________________________________
②点燃钾剧烈燃烧_____________________________________________________
③将小块钾投入冷水中________________________________________________
(3)推测钾在自然界中的存在方式是____________(填“游离态”或“化合态”)
(4)该小组研究钾的性质时用到了哪些主要方法:_________________________。
他们是按照怎样的程序来研究金属钾的性质的:____________________________
______________________________________________________________________。
22.(8分)实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是____________。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为_______________ 。
| 得分 | 评卷人 |
四、(本题共9分)
23.A、B、C、D、E五种物质转化关系如下:
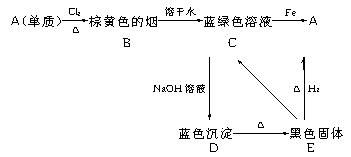
(1)确定A、B、C、D、E各为什么物质:
A________ ,(0.5分)B________ ,(1分)C________ ,(1分)
D____________,(1分)E____________ 。(0.5分)
(2)写出下列各步反应的化学方程式:
![]() E A:
;(1分)
E A:
;(1分)
![]() C D:
;(1分)
C D:
;(1分)
![]() D E:
;(1分)
D E:
;(1分)
![]() E C:
;(1分)
E C:
;(1分)
![]() C A: 。(1分)
C A: 。(1分)
| 得分 | 评卷人 |
五、(本题共10分)
24.某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
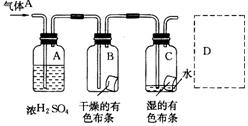
(1)该项研究(实验)的主要目的是_______________ 。
(2)浓H2SO4的作用是_______________ 。
与研究目的直接相关的实验现象是_______________ 。
(3)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是________。
请在图的D处以图的形式表明克服事故隐患的措施。
| 得分 | 评卷人 |
六、(本题共13分)
25.(13分)一块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g,把它投入100 g水中,在常温下放出氢气0.2 g,求:
(1)金属钠的纯度为多少?
(2)被氧化的金属钠的质量为多少?
(3)生成氢氧化钠的质量。
(4)所得溶液中溶质的质量分数。
绝密★启用前
高一化学第一学期阶段学习认证卷
高一化学参考答案
(试题范围:鲁科版必修Ⅰ第一章)
一、选择题(每题只有一个选项符合题意。每题2分,共20分)
1.B本题考查研究物质性质的一般方法。鉴别气体的气味属嗅觉观察。
2.B本题考查钠有关物理、化学性质。钠的硬度小,熔点低,故A、D错;金属钠在空气中燃烧生成过氧化钠,故C错。
3.C配制一定物质的量浓度的溶液时,容量瓶、胶头滴管必有,称量固体须用托盘天平。不使用试管。
4.A本题考查反应条件对反应产物的影响,B项CO2不足时生成CaCO3,CO2过量时生成Ca(HCO3)2,C项常温下生成Na2O,加热时生成Na2O2,D项,O2充足时生成CO2,O2不充足时生成CO。
![]() 5.B氯气有毒故A正确;氯气和液氯是同一种物质(Cl2),氯水是Cl2的水溶液,属成分复杂的混合物,故B不正确;氯气和水反应 Cl2+H2O HClO+HCl,C正确;D中属于氯气的物理性质,D正确。
5.B氯气有毒故A正确;氯气和液氯是同一种物质(Cl2),氯水是Cl2的水溶液,属成分复杂的混合物,故B不正确;氯气和水反应 Cl2+H2O HClO+HCl,C正确;D中属于氯气的物理性质,D正确。
6.B本题考查容量瓶的使用。用容量瓶配制物质的量浓度溶液在定容时,应使液体凹液最低处和环形刻度线相切,只有B正确。
7.C钠与水反应时有以下现象:(1)剧烈反应,因为化学性质活泼;(2)浮在水面上,因为密度比水小;(3)熔化成小球,因为熔点低于水的沸点。以上均与硬度无关。
8.D “84”消毒液是电解饱和食盐水制得的有消毒作用的水溶液,反应为
![]() (1)NaCl+H2O Cl2+H2↑+NaOH (2)NaOH+Cl2 NaCl+NaClO+H2O
(1)NaCl+H2O Cl2+H2↑+NaOH (2)NaOH+Cl2 NaCl+NaClO+H2O
9.C 本题主要考查氯气的毒性及其对环境、食品的污染作用,故选C。
10.C 本题属识记性知识的考查,提出原子学说的科学家是道尔顿。
二、选择题(每题只有一个选项符合题意。每小题3分,共30分)
11.A 左瓶中发生2Na+O2 Na2O2反应,消耗氧气,气压减小,打开活塞有水进入;
右瓶发生C+O2 CO2反应,但反应前后气体的体积不变,气压不变,打开活塞无水进入。
12.C 本题主要考查![]() 的应用,NA是联系宏观和微观的纽带。A中常温常压下 11.2 L氧气中原子数小于NA;B中电子数N(
的应用,NA是联系宏观和微观的纽带。A中常温常压下 11.2 L氧气中原子数小于NA;B中电子数N(![]() )=(1.8 g÷18 g·mol-1)×10×NA= NA;C中N(O)=
)=(1.8 g÷18 g·mol-1)×10×NA= NA;C中N(O)=![]() ×NA=3NA,C正确。
×NA=3NA,C正确。
13.C本题考查物质的量的单位及其意义。摩尔是一种物理量——物质的量的单位,故选C。
14.B本题考查钠与水反应实验仪器及药品。实验过程中应注意培养学生耐心细致的观察能力。取金属钠应用镊子夹取,先用滤纸吸干表面的煤油,然后放到玻璃片上,用镊子按住,再用小刀割下黄豆粒大小的钠块,投入烧杯中。故选B。
15.C A选项中的体积不一定是在标况下;B反应所失去的电子数为NA;32 g O2和 32 g O3质量相同,又都是由氧原子组成,所含的氧原子数都是2NA;D水的状态为液态。
16.A本题主要考查![]() 公式的运用。
公式的运用。
V=c g÷(a g÷![]() )×22.4 L=22.4bc/aNA L。
)×22.4 L=22.4bc/aNA L。
17.B c=![]() =1 mol·L-1,A正确;B应为29.25 g,故B错;C、D均正确。
=1 mol·L-1,A正确;B应为29.25 g,故B错;C、D均正确。
18.D
![]() 19.C 2Na+2H2O 2NaOH+H2↑反应消耗水且放热,有气体生成;饱和石灰水中溶剂减少温度升高,有Ca(OH)2结晶析出使溶液变浑浊,故A、B、D均正确。钠全部和水反应,不可能有银白色物质生成,故C不可能。
19.C 2Na+2H2O 2NaOH+H2↑反应消耗水且放热,有气体生成;饱和石灰水中溶剂减少温度升高,有Ca(OH)2结晶析出使溶液变浑浊,故A、B、D均正确。钠全部和水反应,不可能有银白色物质生成,故C不可能。
|
|
三、(本题共18分)
21.解析:本题属信息题。解题过程要联系Na的有关知识结合题给信息解答。化学用语的书写务求准确规范。
答案:(1)

(2分)
![]() (2)①2K+Cl2 2KCl ②K+O2 KO2 ③2K+2H2O 2KOH+H2↑(3分)
(2)①2K+Cl2 2KCl ②K+O2 KO2 ③2K+2H2O 2KOH+H2↑(3分)
(3)化合态(1分)
(4)观察法实验法分类法(2分)
观察钾的外观性质→预测钾的化学性质→实验与观察→分析、解释、整合、结论(2分)
22.解析:本题属定量实验的考查。问题多属记忆性知识的考查。答题注意细化处理,回忆操作过程,准确作答。
答案:(1)①④⑤⑥;药匙、胶头滴管;(4分)
(2)搅拌;引流(2分)
(3)②①③⑧⑤⑥④⑦④(2分)
四、(本题共9分)
23.答案:(1)Cu;(0.5分)CuCl2固体;(1分)CuCl2溶液;(1分)Cu(OH)2;(1分)CuO(0.5分)
![]() (2)CuO+H2 Cu+H2O;(1分)CuCl2+2NaOH Cu(OH)2↓+2NaCl;(1分)
(2)CuO+H2 Cu+H2O;(1分)CuCl2+2NaOH Cu(OH)2↓+2NaCl;(1分)
![]() Cu(OH)2 CuO+H2O;(1分)CuO+2HCl CuCl2+H2O;(1分)
Cu(OH)2 CuO+H2O;(1分)CuO+2HCl CuCl2+H2O;(1分)
![]() CuCl2+Fe FeCl2+Cu(1分)
CuCl2+Fe FeCl2+Cu(1分)
五、(本题共10分)
24.解析:Cl2本身无漂白性,Cl2与H2O反应生成的HClO有漂白性,Cl2有毒,Cl2易与NaOH溶液发生反应:
![]() Cl2+2NaOH NaClO+NaCl+H2O
Cl2+2NaOH NaClO+NaCl+H2O
答案:(1)比较Cl2与HClO谁有漂白性。(2分)
(2)吸收气体A中的水;B内的布条不褪色,C内的布条褪色。(4分)
(3)Cl2污染空气;措施如下图(4分)
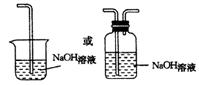
六、(本题共13分)
25.解析:10.8 g固体反应物实际上是金属钠和氧化钠的混合物,其中只有金属钠能与水反应产生氢气。而氢氧化钠是钠、氧化钠与水反应的共同产物。根据反应的化学方程式,从放出氢气的质量可求出金属钠的质量及氧化钠的质量。
解答:设10.8 g反应物中含金属钠的质量为x,根据:
![]()
![]() 2Na+2H2O 2NaOH+H2↑
2Na+2H2O 2NaOH+H2↑
|
x y 0.2 g
![]()
(1)金属钠的纯度:![]() ×100%=42.59%(2分)
×100%=42.59%(2分)
(2)反应物中含氧化钠:m(Na2O)=10.8 g-4.6 g=6.2 g
氧化钠中钠元素(即被氧化的钠)的质量为z。
62∶46=6.2 g∶z z=4.6 g(2分)
(3)设氧化钠溶于水生成的氢氧化钠的质量为b。
![]() Na2O+H2O2
NaOH
Na2O+H2O2
NaOH
62 2×40
6.2 g b
![]() b=8 g
b=8 g
m(NaOH)=8 g+8 g=16 g(2分)
(4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒的关系,m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)=100 g+10.8 g-0.2 g=110.6 g
溶质的质量分数为:![]() ×100%=14.47%(2分)
×100%=14.47%(2分)
![]() 答:(1)金属钠的纯度为42.59%。
答:(1)金属钠的纯度为42.59%。
|
(3)生成的氢氧化钠的质量为16 g。
(4)溶质的质量分数为14.47%。
【考题说明】本套考题考查鲁科版必修1、第一章《认识化学科学》。本章主干知识包括三个方面:(1)在初中化学课程基础上,引领学生走进化学世界,更多地认识和了解化学科学的特点,认识化学科学的创造性和实用性,知道化学是在分子层次上认识物质和合成新物质的一门科学。(2)以氯气和金属钠这两种物质的性质研究为例,了解观察、实验、比较、分类等科学方法对研究物质性质的作用,学习研究物质性质的基本程序。(3)对于物质和化学反应从定性的认识进入定量认识和研究。建立宏观物质的质量、体积与微观粒子之间的联系,突出定量研究的方法对学习和研究化学的重要作用。认识摩尔这一物质的量的基本单位,介绍物质的量、摩尔质量、气体摩尔体积和溶液的物质的量浓度等有关化学计量的知识。
本章重点内容:(1)金属钠和氯气的化学性质;(2)物质的量及其单位、摩尔质量、气体摩尔体积,以及溶液的物质的量浓度的建立。
本考题涉及主干知识有(1)化学科学发展过程中的典型事例;(2)氯气和金属钠的性质及研究物质的方法和程序;(3)物质质量、摩尔质量、气体摩尔体积和溶液的物质的量浓度等有关化学计量知识;(4)配制物质的量浓度一定的溶液实验、钠和氯气性质实验。整体覆盖面达95%以上。
新高考中最易考查的内容:(1)钠和氯气及其相关化合物的性质研究及其方法和程序;(2)以物质的量为中心的有关计算。高考对这部分内容要求较高,不但要理解物质的量,阿伏加德罗常数等概念,而且要熟练运用该部分知识处理实际问题。有关阿氏常数是近几年高考的热点。相关考题在注重计算关系考查的同时,又隐含对某些概念理解的考查。思路趋势为:在正确理解有关概念的基础上,将各物质的质量、气体体积转化为粒子的物质的量进行判断。