高一化学第二学期期中学业水平测试
高一化学
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32
第Ⅰ卷(选择题 共50分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共50分)
1.以煤燃烧释放的热量发电的火电厂每年要排放大量的CO2气体。我国三峡工程提供的清洁、廉价、大功率的可供可再生的水电,相当于每年燃烧3×107t原煤的火力发电厂产生的电能,因此三峡工程有助于控制
A.温室效应 B.氮的氧化物的排放
C.白色污染 D.碳氢化合物的排放
2. “铱星”计划中的铱的一种同位素是![]() ,其核内中子数是
,其核内中子数是
A.77 B.114 C.191 D.268
3.为了减少大气污染,许多大城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料主要成分都是
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
4.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
5.下列物质属于原子晶体的化合物是
A.金刚石 B.刚玉 C.二氧化硅 D.干冰
6.甲烷和氯气的混合气体见光,发生反应的类型为
A.取代反应 B.置换反应 C.化合反应 D.分解反应
7.下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.吸热反应在不加热的条件下一定不能发生
C.放热的反应在常温下一定很容易发生
D.反应是放热的还是吸热的须看反应物和生成物所具有的总能量的相对大小
8.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素原子量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
9.下列反应中,既属于氧化还原反应又属于吸热反应的是
A.氢氧化钾与硫酸的反应 B.灼热的碳与二氧化碳反应
C.镁条在空气中燃烧 D.Ca(OH)2与NH4Cl反应
10.实现下列变化时,需克服相同类型作用力的是
A.水晶和干冰的熔化 B.食盐和钢铁的熔化
C.液溴和液汞的气化 D.纯碱和烧碱的熔化
11.能源划分为一级能源和二级能源。自然界以现成方式提供的能源称为一级能源;需依靠其它能源的能量间接制取的能源称为二级能源。下列叙述正确的是
A.氢气是二级能源 B.水力是二级能源
C.天然气是二级能源 D.水煤气是一级能源
12.“绿色化学”要求从根本上减少乃至杜绝污染。下列对农作物收割后留下的秸秆的处理方法中,不符合“绿色化学”的是
A.就地焚烧 B.发酵后作农家肥
C.加工成精饲料 D.制造沼气
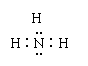 13.下列物质的电子式书写正确的是
13.下列物质的电子式书写正确的是
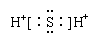
![]() A.
B.
A.
B. ![]()
|
14.下列跟红磷和白磷的关系相同的一组物质是
A.![]() 和
和![]() B.
B.![]() 和
和![]()
C.正丁烷和异丁烷 D.金刚石和石墨
15.下列装置能构成原电池的是
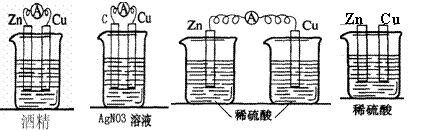
A B C D
16.下列各组物质中,互为同分异构体的是
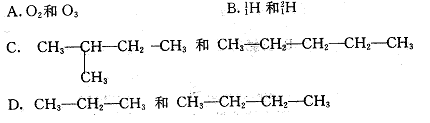
17. 关于可逆反应达到平衡的说法错误的是
A.外界条件不能改变平衡 B.正、逆反应速率相等
C.各组分的含量不随时间而变化 D.是动态平衡
18.下列关于乙烯和乙烷的说法中错误的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能
C.乙烯比乙烷稳定
D.乙烯分子中所有原子均在同一平面上,乙烷分子所有原子不在一个平面上
19.下列物质的分子中,不含共价键的是
A.NaCl B.Cl2 C.HCl D.NaOH
20.下列过程中,需要增大化学反应速率的是
A.钢铁腐蚀 B.食物腐败 ![]()
C.塑料老化 D.工业合成氨
21.钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
A.Fe -2e-= Fe2+ B.Fe -3e- = Fe3+
C.O2 +2H2O +4e- = 4OH- D.2H+ + 2e- = H2 ↑
22. 1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g); △H = +393.5 kJ/mol
B.C(s)+O2(g)=CO2(g); △H = -393.5 kJ/mol
C.C+O2=CO2 ; △H = -393.5 kJ/mol
D.C(s)+![]() O2(g)=CO(g); △H = -393.5 kJ/mo
O2(g)=CO(g); △H = -393.5 kJ/mo
23.把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D → C;A、C相连时,C极上产生大量气泡;B、D相连时,D极发生氧化反应。这四种金属的活动顺序是
A. A>B>C>D B. A>C>D>B
C. C>A>B>D D. B>D>C>A
24.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是
| 化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
| 键能/kJ·mol-1 | 436 | 431 | 299 | 247 | 193 |
A.HCl B.HBr C.H2 D.Br2
25.反应4NH3(气)+5O2(气)= 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010mol/(L·s) B.v(O2)=0.0010mol/(L·s)
C.v(NO)=0.0010mol/(L·s) D.v(H2O)=0.0045mol/(L·s)
第Ⅱ卷(非选择题 共50分)
二、填空题(共24分)
26.(8分)现有①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘片 六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 , 熔点最高的是 ,熔点最低的是 。
(2)属于离子晶体的是 ,只含有离子键的物质是 ,晶体含有两种化学键的是 ,含有分子间作用力的是 。
27.(6分)(1)从组成上看,甲烷、乙烷、乙烯、乙炔等均只由 、 两种元素组成,这一类化合物称为 。
(2)化学式为C8Hm的烷烃,m值等于 ;CnH22 的烷烃,n值等于 ;相对分子质量为128的烷烃的分子式为 。
28.(6分)第三周期元素A、B、C,其原子序数依次增大,已知A的焰色为黄色,C的某种氧化物是形成酸雨的主要原因,且这三种元素的最高价氧化物的水化物有一种具有两性,且他们两两之间都能反应生成盐和水。
(1)填出元素符号A __________B __________C__________
(2) C 2-- 离子结构示意图为
(3)A和C形成的化合物的电子式为 ,属于 晶体
29.(4分)阅读下列材料,回答问题:
在倡导节约型社会的今天,面对能源日趋紧张的局面,化学学科要义不容辞地承担起开发新能源与提高能源利用率的重任。我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。煤的液化和气化技术是煤炭工业的绿色化学技术。煤的气化是把煤中的有机物转化为可燃性气体(主要成分是CO和H2)的过程。如果要得到高热值的燃气,需要进一步将中热值燃气中的CO和H2在催化的条件下合成CH4与一种液体。
(1)试写出CO和H2在催化条件下合成CH4的化学方程式
。
(2)节约能源,人人有责。请提出一条日常生活中的节能措施:
。
三、实验题(共14分)
30.(6分)原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①两支试管均产生大量气体,盛____________的试管中气体产生较快,盛____________的试管中气球变得更大;
②某同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。该同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) ==== H2O(l)+ CO2(g) ; △H>0
CO32-(aq)+ 2H+(aq)==== H2O(l) + CO2(g) ; △H<0
你认为该同学下结论的方法是否正确 (填正确或不正确)。
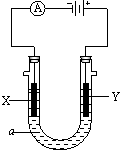 31.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通 过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
31.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通 过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
(1)电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是
。
(2)Y电极上的电极反应式为 ,
检验该电极反应产物的方法是
。
四、计算题(共12分)
32.(5分)某烃分子中,碳、氢元素的质量比为9∶1,相对分子质量为120。求此烃的分子式。
33.(7分)在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应2 min后,A的浓度从开始时的1.0 mol·L-1降到0.8 mol·L-1。已知反应开始时B的浓度是1.2 mol·L-1。求:
(1)2 min末B、C的浓度。
(2)以单位时间内A的浓度的减小来表示2 min内该反应的平均速率。
参考答案
一、选择题(共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | B | B | B | C | A | D | C | B | D | A | A | B |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | D | B | C | A | C | A | D | C | B | B | D | C |
二、填空题(共24分)
26.(1)⑤⑥; ②; ②; ⑤
(2)①③④; ①; ③④; ⑤⑥ (每格1分,共8分)
27.(1)C ; H; 烃 (2)18; 10; C9H20 (每格1分,共6分)
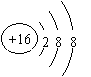 28.(1)Na; Al; S;
28.(1)Na; Al; S;
(2) S 2- (3) ;离子 (每格1分,共6分)
|
![]() (1)CO+3H2 CH4 +H2O (2)随手关灯等。 (每格2分,共4分)
(1)CO+3H2 CH4 +H2O (2)随手关灯等。 (每格2分,共4分)
三、实验题(共14分)
![]() 30. ①NaHCO3;NaHCO3 ; ②不正确
(每格2分,共6分)
30. ①NaHCO3;NaHCO3 ; ②不正确
(每格2分,共6分)
31.(1)2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑; 酚酞变红,有气泡产生。
(2)2Cl- - 2e- == Cl2↑,用湿润的淀粉碘化钾试纸放在Y极附近观察现象
四、计算题(共12分)
32.(5分)C9H12
33.(7分)(1)c(B)= 0.8 mol·L-1、c(C) = 0.6 mol·L-1。
(2)v(A) = 0.1 mol·L-1·min-1