高一化学第二学期期中考试试卷
高一化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟。收交试卷时,只交答案卡。。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 K 39 Cl 35.5 Fe 56 Ag 108
第Ⅰ卷(选择题 共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.有关化石燃料的说法正确的是 ( )
A. 化石燃料是可再生的,因此地球上的蕴藏量也是无限的
B. 化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速度相当快,所以化石燃料相当于是无限的
C. 化石燃料的形成是非常复杂的,所需时间也较长,但化石燃料在地球上的蕴藏量是无限的
D. 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生能源
2.我国三峡工程提供的清洁、廉价、大功率的可供可再生的水电,相当于每年燃烧![]() 原煤的火力发电厂产生的电源,因此三峡工程有助于控制 ( )
原煤的火力发电厂产生的电源,因此三峡工程有助于控制 ( )
A. 温室效应 B. 氮的氧化物的排放
C. 白色污染 D. 碳氢化合物的排放
3.1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子![]() X的中子数与电子数之差为
( )
X的中子数与电子数之差为
( )
A.0 B.57 C.118 D.175
4.铜片和锌片用导线连接后插入稀硫酸中,锌片是 ( )
A.阴极 B.正极 C.阳极 D.负极
5.下列关于化学反应速率的说法,不正确的是 ( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.单位时间内某物质的浓度变化大,则该物质反应就快
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1
6.下列微粒中:①![]() ②
②![]() ③
③![]() ④
④![]() ,其核外电子数相同的是( )
,其核外电子数相同的是( )
A.①②③ B.②③④ C.①②④ D.①③④
7.下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.吸热反应不加热的条件一定不能发生
C.放热的反应在常温下一定很容易发生
D.反应是放热的还是吸热的须看反应物和生成物所具有的总能量的相对大小
8.下列物质的分子中,不含共价键的是 ( )
A.NaCl B.Cl2 C.HCl D.NaOH
9.下列各图中,表示正反应是吸热反应的图是 ( )
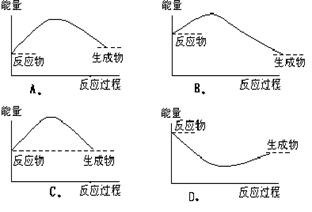
10.下列各组物质中,互为同分异构体的是 ( )
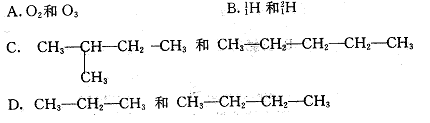
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11. 根据下表中所列键能数据,判断下列分子中,最不稳定的分子是 ( )。
| 化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
| 键能/ | 436 | 431 | 299 | 247 | 193 |
A.
![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
12. 已知:A、B两元素的阴离子具有相同的电子层结构;B元素的阴离子半径大于A元素的阴离子半径;C和A两元素的最外层电子数相同;C元素的原子半径大于A元素的原子半径。A、B、C三种元素的原子序数的关系是 ( )。
A. ![]() B.
B. ![]() C.
C.
![]() D.
D.
![]()
13.下列属于直接利用太阳辐射能的方式的是 ( )
①光-热转换 ②光-电转换 ③光-化学能转换 ④光-生物质能转换
A.①②③ B.①③④ C.①②④ D.①②③④
14. 将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是( )
A. 盐酸浓度不变,使用量增大1倍 B. 盐酸浓度增加1倍,用量减至1/2
C. 增大碳酸钠粉末的用量 D. 使反应在较高温度下进行
15、总结出元素周期表的化学家是
A、居里夫人 B、侯德榜 C、门捷列夫 D、道尔顿
16.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是 ( )
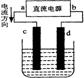 A.a为正极、b为负极
A.a为正极、b为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
17.下列各组顺序的排列不正确的是 ( )
A.原子半径:Na<Mg<Al B.热稳定性:HCl<H2S<PH3
C.酸性强弱:H2SiO4<H2CO3<H3PO4 D.溶点:NaCl>Na>CO2
18、可逆反应:![]() 在密闭容器中反应,达到平衡状态的标志是
在密闭容器中反应,达到平衡状态的标志是
(1)单位时间内生成![]() 的同时生成
的同时生成![]()
(2)单位时间内生成![]() 的同时,生成
的同时,生成![]()
(3)用![]() 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. (1)(4)(5) B. (2)(3)(5)
C. (1)(3)(4) D. (1)(2)(3)(4)(5)
19.下列说法中,错误的是
A.含有离子键的化合物一定是离子化合物
B. 含有共价键的化合物一定是共价化合物
C.共价化合物中一定含有极性共价键,肯定不含离子键
D.离子化合物一定含有离子键,可能含有共价键.
20.下列物质在一定条件下能与甲烷发生取代反应的是:
A.水 B.溴蒸气 C.氯气 D.HCl
第Ⅱ卷(非选择题 共80分)
三、填空题(共分)
21.(7分,每空1分)下表是元素周期表的一部分,回答下列问题:
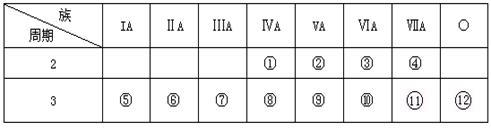
(1)写出①、③两种元素形成的化合物有两种,化学式:____ , ____。
(2)写出①元素最高价氧化物的电子式和结构式____ , ____。
(3)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________。
22.(4分)阅读材料,回答问题:
(1)某无色液体A,在通电的条件下能生成无色气体B和C,B能使带火星的木条着火,C能在空气中燃烧,发出淡蓝色火焰且只生成A。则B、C的化学式分别为, , 。(每空各1分)
(2)能源可分为一级能源和二级能源。自然界以现存形式提供的能源称为一级能源;需要依靠其他能源的能量间接制取的能源称为二级能源。有人认为,气体C是一种优质能源,你认为气体C作为能源的最突出的优点是 (2分).
23.(4分)在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是 ,原子半径最小的元素是 。
(2)单质的还原性最强的元素是 ,单质的氧化性最强的元素是 。
24.(4分)下列五种物质中,①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。
| A | ||
| B | C |
25.(14分) 如图为短周期的一部分。B、C两元素原子的
核外电子数之和等于A原子质量数的2倍,
A原子核内质子数和中子数相等。
试回答:
(1)A、B、C元素的元素符号___________、__________、_________。
(2)B在元素周期表中的位置_______________,原子结构示意图为____________,C的阴离子电子式为______________,B与C形成化合物的分子式为_______________。
26.(4分) 原电池是一种 装置。在原电池中,较活泼的金属发生 反应,是____极;活动性较差的金属上发生 反应,是____极。
27.(4分) 如果反应物的总能量小于生成物的总能量,该反应为____________反应.在反应中反应物需要__________能量.
28.(8分) 下列反应属于放热反应的是
下列反应属于吸热反应的是
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.铁和稀硫酸的反应 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl反应 F. 锌粒与稀H2SO4反应制取H2
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
I.碳酸钙高温分解成氧化钙和二氧化碳
J. 二氧化碳与赤热的碳反应生成一氧化碳
29.(6分)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn + 2OH— = ZnO + H2O + 2e— ; Ag2O + H2O + 2e— = 2Ag + 2OH—
电池的负极是______________,正极发生的是_______________反应(反应类型),
总反应式为______________________________________________________________
30.(4分)现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D分别浸入稀硫酸中,产生气泡都很快;把A、B用导线连接浸入稀硫酸中时,A上有气泡析出;把C浸入D的硝酸盐溶液中,C的表面有D析出。
这四种金属的活动性顺序由强到弱为 。
31.(3分) 在2N2O5
== 4NO2 + O2反应中,N2O5的起始浓度为2.1![]() ,经100秒钟后,N2O5的溶液为1.95
,经100秒钟后,N2O5的溶液为1.95![]() ,则反应速率:
,则反应速率:![]() =
=
32.(5分)分子中含有34个氢原子的烷烃含碳原子_______个, 化学式为_______;
通常情况下为气态, 分子中含碳原子数最少的烷烃的俗名是____________________,它与氯气反应的化学方程式为___________________
33. (9分)写出下列物质的电子式以及①②③的结构式
①H2S , , ④Na2O
②NH3 , , ⑤MgF2
③CO2 , , ⑥NaOH