高一化学第二学期期末考试试卷
化学
命题:祝毅宏(崇庆中学) 审题:杨晓冬(崇庆中学)
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间:90分钟,分值100分。
第Ⅰ卷1-18题;第Ⅱ卷19-24题。第Ⅰ卷1-18题用2B铅笔填涂于机读卡上;第Ⅱ卷19-24题用蓝黑色笔作于试卷上。
可能用到的相对原子质量: H-1 C-12 O-16 Na-23
S-32 Cl-35.5 Zn—65
第I卷(选择题共54分)
一、选择题(本题有18个小题,每小题3分,共54分。每小题只有一个选项符合题意)
1、科学家研究发现,用“汽水”(一种能释放CO2的弱酸性溶液)浇灌植物能促进植物的生长。原因是它能
① 加强呼吸作用 ② 加强光合作用
③ 改良碱性土壤、调节pH值 ④ 加强植物蒸腾作用
A. ①② B. ②③ C.③④ D.②③④
2、下列分子中所有原子都满足最外层为8个电子结构的是
A.BF3 B.SiCl4 C.H2O D.PCl5
3、物质之间发生化学反应时,一定发生变化的是
A.颜色 B.状态 C.原子核 D.化学健
4、下列物质露置于空气中,均会变质,其中不是因为发生氧化还原反应而变质的是
A.氢硫酸 B.烧碱溶液 C.亚硫酸钠 D.氯水
5、科技报道:美国夏威夷联合天文台中心的科学家发现了新的氢微粒。这种氢微粒是由3个氢原子核和2个电子构成的,这对解释宇宙演化提供了新的参考。对于这种氢微粒,下列说法错误的是
A.可以推测它的化学性质与H2不同 B.它比普通氢分子多一个氢原子核
C.它的组成可以用H3+表示 D.它一定含有3个中子
6、在通常状况下,下列各组气体能共存,又都能用浓H2SO4干燥的是
A.O2、H2S、CO2 B.H2、HBr、Cl2
C. O2、N2、NO D.CO2、HCl、Cl2
7、下列各组物质中化学键的类型相同的是
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. CaCl2 NaOH H2O D. NH3 H2O CO2
8、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A. 由二氧化碳合成金刚石是化学变化
B. 金刚石是碳的一种同位素
C. 钠被氧化最终生成碳酸钠
D. 金刚石中只含有非极性共价键
9、含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A、Na2S B、NaHS
C、Na2S和NaHS D、NaOH和NaHS
10、元素周期表中ⅠA族元素有R′和R″两种同位素, R′和R″的相对原子质量分别为a和b,R元素中R′和R″原子的百分组成分别为 x 和 y ,则R元素的碳酸盐的式量是
A、2(ax+by)+60 B、 ax+by+60 C、(ax+by)/2+60 D、 ay+bx+60
11、对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
12、下列离子方程式书写正确的是
A. 过量的NaHSO4和Ba(OH)2溶液反应:
H+ + SO42- + Ba2+ + OH -= BaSO4↓+ H2O
B. NH4HCO3和过量NaOH溶液相混合: HCO3- + OH- = CO32- + H2O
C. FeS和稀H2SO4反应: FeS + 2H+ == H2S↑+ Fe2+
D. 用氨水吸收少量SO2: NH3 + H2O + SO2 = NH4+ + HSO3-
13、将木炭与浓H2SO4共热后得到的气体通入下列溶液中,溶液不可能出现浑浊的是
A.泡花碱 B.饱和H2S溶液 C.足量Ba(OH)2溶液 D.溴水
14、标准状况下将一充满NO2 NO O2混合气体试管倒立于水中,气体全溶解且无气体剩余,若试管内的产物不扩散,则试管内溶液的物质的量浓度为.
A. 1/39.2<C<1/28 B. 0<C<1/22.4
C. 1/39.2<C<1/22.4 D. 1/28<C<1/22.4
15、能够说明硫的非金属性比氯弱的事实有:
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态。
A.①③ B.①②③ C.②④ D.①②③④
16、在野外,为了迅速得到氢气,可以用较纯的硅粉与干燥的氢氧化钙和氢氧化钠混合,加强热,即可迅速得到氢气,反应方程式Si+Ca(OH)2+2NaOH=Na2SiO3+CaO+2H2![]() ,在这个反应中,Si的作用是
,在这个反应中,Si的作用是
A.还原剂 B.氧化剂 C.催化剂 D.既是氧化剂又是还原剂
17、密度为![]() 的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
A.等于12.5% B.大于12.5%
C.小于12.5% D.无法确定
18、向20ml1mol/L NaHCO3溶液中通入一定量的SO2后恰好完全反应,在生成的溶液中Na+和溶液中化合态硫的物质的量之比为4:3,则通入的SO2在标准状况下的体积为
A 0.448L B 0.336L C 0.224L D 0.112L
第II卷(共46分)
二:填空题
19、(8分)在原子序数1—18号元素中:(用化学符号填空)
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_____________。
(4)除稀有气体外,原子半径最大的元素是_________。
(5)原子半径最小的元素是_____________。
(6)气态氢化物水溶液呈碱性的元素是_____________。
(7)气态氢化物最稳定的化学式是_____________。
(8)最高价氧化物对应水化物的酸性最强的元素是_____________。(1分/空)
20、(12分)X、Y、Z和W代表原子序数依次增大的四种短周期非金属元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W相邻;X无中子。
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):____,
理由是 。
(2)Y是________,Z是__________,W是__________。(用化学符号填空)
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1,
写出该化合物的化学式_____________。(2分/空)
21、(7分)某无色透明的澄清溶液,可能含有较大量的Cu2+、OH-、NO3—、Cl-、
HCO3—、H+、K+等离子中的两种或多种,现进行如下实验:
①取溶液少量加入碳酸钠粉末有无色无味气体放出;
②另取原溶液少许,加入硝酸银溶液无沉淀生成。
(1)由此判断原溶液中一定含有的离子是 ;一定不含有的离子是
;可能含有的离子是 。(1分/空)
(2)为了检验上述溶液中可能含有的离子是否一定存在,你认为还应该继续进行
的实验操作是: ;对应的实验现象
和结论是 。(2分/空)
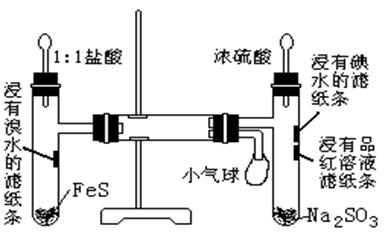
22、(7分)观察图中所示,回答下列问题:
|
|
|
|
|
⑴、硬质玻璃管中的现象: 。
⑵、写出B装置中发生反应的化学方程式 。
A、 B装置中产生的气体能否用启普发生器制取?请选择: 。
①只有A可以 ②只有B可以
③ A、B均可以 ④A、B均不可以
⑶、滤纸条的变化:①
②
③
。
⑷、小气球的作用: (1分/空)
23、(7分)已知A为一种白色易溶于水的正盐晶体,B是一种有重要用途的气体,C、G都为氧化物,E是一种能使品红溶液褪色的气体,H为红色金属单质,I为空气中含量最多的单质。它们之间的转化关系如下图所示:
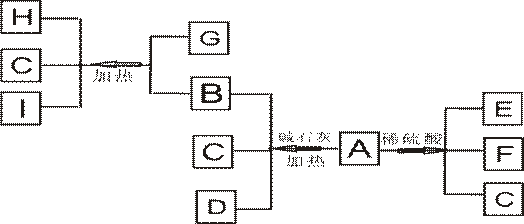
⑴:A的化学式(分子式)为 ,I的电子式为 。
⑵:B物质有一些特殊的性质,由于易 ,所以常用作致冷剂;当人的眼睛不
慎接触过多的B气体时,要 。用离子方程式表示B使红色石
蕊试液变蓝的原因: 。
⑶:G和B生成H、C、I的化学方程式是 。
⑷:A与稀硫酸反应的离子方程式是 。
(1分/空)
三:计算题(5分)
24.现有物质的量浓度为18.4mol/L的浓硫酸20.0mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水到100.0mL,测得溶液中SO42-的物质的量浓度为3.18mol/L。试求该100mL溶液中CuSO4的物质的量浓度
期末考试化学试卷参考答案
第I卷(选择题共54分)
一、选择题(本题有18个小题,每小题3分,共54分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | B | D | B | D | D | D | B | A | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
| C | C | D | A | B | A | C | B |
|
|
第II卷(共46分)
二:填空题
19:(8分)
(1)Na (2)F2 (3)Cl2 F2 (4)Na (5)H (6)N (7)HF (8)Cl
(1分/空)
20:(12分)
(1)否。若三者处于同一周期,则最外层电子数之和不可能为17。
(2)N,O,S (3)(NH4)2SO4(2分/空)
21:(7分)
(1)H+、NO3— ;Cu2+、OH-、HCO3—Cl-;K+(1分/空)
(2)用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,隔着蓝色钴玻璃观察火焰颜色 ; 若火焰呈紫色,则原溶液中含有K+,反之则不含K+ 。(2分/空)
22:(7分)
⑴、在硬质试管壁出现淡黄色固体。
⑵、Na2SO3+H2SO4=Na2SO4+SO2![]() +H2O ①
+H2O ①
⑶、①滤纸上橙色溴水颜色褪去,出现黄色物质。②滤纸上碘水黄色颜色逐渐消失。③滤纸上品红溶液红色逐渐消失。
⑷、储存未反应完的SO2 或H2S,防止污染环境。(1分/空)
23:(7分)
⑴A: (NH4)2SO3 ,I: ![]() 。
。
⑵ 液化 ; 用大量水冲冼 。
NH3+H2O![]() NH3•H2O
NH3•H2O![]() NH4++OH- 。
NH4++OH- 。
⑶ 2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
⑷ SO32-+2H+=SO2↑+H2O (1分/空) 。
24:(5分)
0.5Mol/L: