高一化学第二学期期末调研测试试题
高 一 化 学(选修)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷(第1至18题),第Ⅱ卷(第19至25题),共100分,考试时间90分钟。
第Ⅰ卷(选择题 共44分)
注意事项:
1、 答第Ⅰ卷前,考生务必将本人的学校、姓名、考试号等信息填在第Ⅱ卷的密封线内。
2、 将第Ⅰ卷上每小题所选答案的字母标号填在答题栏上。在第Ⅰ卷上答题无效。
3、 考试结束后将第Ⅱ卷交监考老师。
可能用到的相对原子质量:
H:1 C:12 O:16 Al:27 Si:28 P:31 S:32 Cl:35.5 Cu:64 Ag:108
一、选择题(本题共10题,每小题只有一个选项符合题意,每小题2分,共20分)
1.在物质结构研究的历史上,根据量子论的观点,首先提出原子核外电子在一系列稳定轨道上运动并较好地解释了氢原子光谱的科学家是
A.汤姆生 B.卢瑟福 C.道尔顿 D.玻尔
2.决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度、压强以及反应物的接触面 D.反应物的浓度
3.下列各组元素属于p区的是
A.Na、N、P B.O、S、Ar
C.Fe、Ar、Cl D.H、Mg、Al
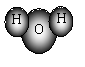 4.下列微粒的表达式中不正确的是
4.下列微粒的表达式中不正确的是
|
C.铜原子的外围电子排布式:3d94s2
D.O—18原子的符号:![]()
5.下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.CO2和H2O B.NaOH和CH4
C.SiO2和CO2 D.NaCl和HCl
6.下列各组物质中互为同素异形体的是
A.H2O与D2O B.12C和14C
C.乙醇与二甲醚(CH3-O-CH3) D.氧气与臭氧
7.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A.半导体材料砷化镓 B.透明陶瓷材料硒化锌
C.吸氢材料镧镍合金 D.超导材料K3C60
8.2006年11月16日,俄美两国科学家共同宣布发现了第118号元素,已知第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是
A.位于周期表的第七周期第ⅣA族
B.原子的最外层有4个电子
C.肯定是非金属元素
D.常见的化合价有+2和+4价
9.下列有关晶体的说法中正确的是
A.原子晶体中共价键的键能越大,共价键越牢固
B.晶体中分子间作用力越大,分子越稳定
C.冰熔化时分子中氢氧共价键发生断裂
D.金属晶体均具有很高的熔点
10.第3周期某元素的原子,其最外层3p亚层上有一个未成对电子,则关于该元素的描述正确的是
A.该元素最高价氧化物的水化物肯定是一种强酸
B.该元素单质可能是一种黄绿色的气体
C.该元素最高价氧化物的水化物肯定是一种强碱,只能与酸反应
D.该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外)
二、选择题(本题包括8小题,每小题3分,共24分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
11.氢气虽然是一种理想的绿色能源,但目前仍处在研究、试验阶段,还未得到广泛应用,其原因可能是
A.氢气虽可由水制备获得,但水资源严重匮乏
B.氢气制备耗能巨大,廉价制氢技术尚未成熟
C.氢气贮存、运输等安全技术尚未很好的解决
D.氢气燃烧产物虽无污染,但其放出热量较少
12.下列说法中不正确的是
A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键
B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3
C.铁质器件附有铜质配件,在接触处易生铁锈
D.在多电子原子中,5s轨道能量比3d轨道能量高
13.下列递变规律正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.N、O、F的第一电离能依次增大
C.钠、镁、铝的还原性依次减弱
D.P、S、Cl最高正价依次升高
14.根据下表中的数据,结合学过的化学知识,判断下列说法正确的是
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
A.以上四种物质中,只有SiCl4是共价化合物
B.若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点
C.因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备Al
D.据上述数据,可判断NaCl、MgCl2为分子晶体
15.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.在相同条件下,单质与同浓度稀盐酸反应的速率:L>R
B.M与T形成的化合物具有两性
C.Q、T两元素的氢化物分子间都存在氢键
D.L、Q形成的简单离子核外电子数相等
16.可逆反应:2NO2(g) ![]() 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
① 单位时间内生成n mol O2的同时生成2 n mol NO2
② 单位时间内生成n mol O2的同时生成2 n mol NO
③ 用NO2、NO、O2表示的反应速率数值之比为2∶2∶1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
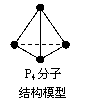 17.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
17.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.常温常压下,16 g 14CH4所含中子数为8×6.02×1023
B.电解精炼铜当转移0.2×6.02×1023个电子时阳极溶解6.4 g铜
C.30 g二氧化硅晶体中含硅氧共价键的数目为2×6.02×1023
D.6.2 g白磷P4(右图)中所含的P-P键的个数为0.2×6.02×1023
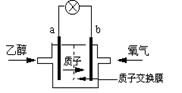 18.一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH
+3O2=2CO2
+3H2O。下列说法不正确的是
18.一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH
+3O2=2CO2
+3H2O。下列说法不正确的是
A.a极为电池的正极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.每消耗1 mol乙醇,反应中转移电子数为6 NA
高一化学第二学期期末调研测试试题
高 一 化 学(选修)
| 卷别 | 第Ⅰ卷 | 第Ⅱ卷 | 总分 | 积分人 | ||
| 题号 | 一、二(1-18) | 三(19-20) | 四(21-23) | 五(24-25) | ||
| 得分 | ||||||
注意事项:
1、 请用0.5mm签字笔直接答在试卷上。
2、 答卷前将密封线内项目填写清楚。
3、 Ⅰ卷答案请填在下列答题栏中。
| 得分 | 评卷人 |
第Ⅰ卷(选择题 共44 分)
第Ⅰ卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 |
第Ⅱ卷(非选择题 共56 分)
| 得分 | 评卷人 |
三、(本题包含2小题,共16分)
19.(5分)在下列①NH3、②NH4Cl、③金刚石、④KBr、⑤甲烷、⑥CO2、⑦Ar七种物质中,请用编号填空:其中只含有离子键的是 ,只含有共价键且为直线型分子的是 ,空间构型为正四面体结构的分子是 ,熔点最高的是 ,不存在化学键的物质是 。
20.(11分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用________能,还能为农业生产提供优良的肥料。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧的热化学方程式____________________________________。
(3)在生产和生活中经常遇到化学能与电能的相互转化。在下列甲、乙两装置中,甲中负极电极反应式为_____________________,溶液中的阳离子向_____极移动;乙中铁电极的电极反应式为_____________________,发生______反应(填“氧化”或“还原”)。
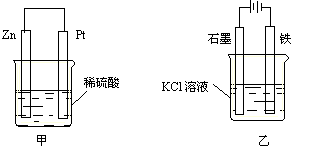 |
| 得分 | 评卷人 |
四、(本题包含3小题,共28分)
21.(11分)下表是元素周期表的一部分:
| 族 周期 | I A | IIA | IIIA | IVA | VA | VI A | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ | |||||||
请从上表①~⑩十种元素中选择适当的元素符号回答下列问题:
(1)金属性最强的是 ,电负性最大的是 ,原子半径最小的是 ,第一电离能最大的是 ;
(2)用电子式表示⑥和⑨形成化合物的过程 ;
(3)⑥、⑦两元素的第一电离能的大小:⑥ ⑦(填“>”、“<”符号;下同);③、⑧两元素形成的氢化物沸点高低顺序为:③ ⑧;
(4)写出⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式 ;
(5)表中元素形成的多核10电子阴离子的化学式为 。
22.(9分)A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的轨道表示式是 ;D元素原子的外围电子排布式是 ;A2B2的电子式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
(3)写出B、D、E三种元素中两种元素形成的化合物的化学式 (不
少于四种)。
23.(8分)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,
用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过
热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
| H:2.1 | ||||||
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
请仔细分析,回答下列问题:
(1)你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
(2)预测Te元素χ的值 ;
(3)根据表中所给数据分析研究推测:
同主族的不同元素的电负性变化的规律是___________________________________;同周期中,电负性与原子半径的关系为________________________________。
(4)一般认为,当两种成键元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。根据H和F的电负性差值能否判断HF是离子化合物,并说明理由: ;
。
(5)2005年1月美国科学家在《Science》上发表论文,宣布发现了Al的超原子结构Al13和Al14,并预言其它金属原子也可能存在类似的结构。这种超原子具有40个价电子时最稳定。请预测Al14与周期表中 族元素的性质相似。
| 得分 | 评卷人 |
五、(本题含2小题,共12分)
24.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:
4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
25.(6分)已知X、M、N为周期表中1~20号元素,
(1) X的最高正化合价与最低负化合价的代数和为4,且X在最高价氧化物中的质量分数为40%,则X在周期表中的位置是________________________;
(2)4.5 g金属单质M与足量的硫酸溶液完全反应放出氢气,电子转移的个数为3.01×1023,则该金属M是___________;
(3) N元素的同位素AZN,它的氯化物NCl2 2.22 g溶于水制成溶液后,加入2 mol·L-1的AgNO3溶液20 mL,恰好完全反应。若这种同位素原子核内有20个中子,则Z=____________。
高一化学第二学期期末调研测试试题
高一化学(选修)参考答案及评分标准
第I卷(共44分)
一. 选择题(1~10每题2分,11~18每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | B | C | A | D | B | C | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | BC | B | CD | B | AB | A | C | AD |
三、(本题包含2小题,共16分)
19.④ ⑥ ⑤ ③ ⑦(每空1分,共5分)
20.(1)吸热 放热 放出 5.5(每空1分,共4分)
(2)生物质(1分) CH4(g) + 2O2(g) = CO2 (g) + 2H2O;△H=-890.0kJ/mol(2分)
(3)Zn -2e- = Zn2+,正极;2H+ + 2e- = H2↑,还原(每空1分)
四、(本题包含3小题,共28分)
21、⑴K F H Ne (每空1分,共4分)
⑵2 +·Mg· (2分)
(3)> > (每空1分,共2分)
(4)Al(OH)3 + 3H+ = Al3+ + 3H2O (2分)
(5)OH- NH2-(只要写出一个就可)(1分)
|
| ||
| ↑↓ | ||
| ↑↓ | ↑↓ | ↑ |
22.(1)![]() 3S23P5
3S23P5
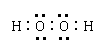 |
每空1分
(2)HF>HCl(1分)
(3)NaCl Na2O Na2O2 Cl2O ClO2 Cl2O7等(4分)
(写对四个给4分,错写一个倒扣1分,扣完为止,不出现负分)
23.(1)吸引电子的能力(1分)
(2)2.0<χ<2.4(1分)
(3)从上到下呈现减小的趋势(1分) 电负性越大,原子半径越小(1分)
(4)不能(1分) 因这是一条经验规则,但由于H、F都是非金属元素,一般易形成共价化合物,这是一种特殊情况。(2分)
(5)第ⅡA族元素(1分)
五、(本题含2小题,共12分)
24.(1)0.05 mol·L-1·min-1 2分
(2)0.175 mol·L-1 2分
(3)n=4 2分
25.(每空2分,共6分)
(1)第三周期第ⅥA族 (2)铝(Al) (3)20