高一化学第二学期期末调研考试
高一化学试题
(命题人:陆蓁 刘文兵 审题人:刘文兵 范新华)
本试题包括五大题,24小题,满分100分。考试时间90分钟。
注意:1.答题前,考生务必将密封线内各项填写清楚。
2.选择题答案填在答题卡上,其它试题答案直接写在试题规定位置。
可能用到的相对原子质量:H一1 C—12 O—16 Na-23 Al—27 Cl-35.5 Fe-56
一、单项选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意)
1.2007年6月5日是第36个世界环境日,我国环保总局确定的主题见右图。
 下列措施不符合这一主题的是
下列措施不符合这一主题的是
A.用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.回收废电池,减少对环境的污染
C.将工厂的烟囱造高,以减少工厂周围的大气污染
D.提倡车用乙醇汽油代替传统的燃油,以减少有害气体的排放量
2.化学与生活密切相关,下列有关说法不正确的是
A.淀粉、蛋白质、脂肪都属于营养物质 B.乙烯可用作水果的催熟剂
C.用食醋可以清除暖瓶或水壶中的水垢 D.只用淀粉溶液就可鉴别市售食盐是否为加碘盐
3.美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,
该元素原子核内的中子数和核外电子数之差为
A.47 B.57 C.61 D.175
![]() 4.下列化学用语的书写正确的是
4.下列化学用语的书写正确的是
![]() A.乙酸的分子式:C2H4O2
B.乙醇的结构简式:C2H6O
A.乙酸的分子式:C2H4O2
B.乙醇的结构简式:C2H6O
C.F原子结构示意图: D.四氯化碳的电子式:
5.煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油
和天然气为主要原料生产的合成材料是
A.塑料 B.合成橡胶 C.淀粉 D.合成纤维
6.下列各组物质,能互称为同系物的一组是
A. 78 34Se和80 34Se B.CH2=CH2和CH3CH2CH=CH2
C.一氯甲烷和二氯甲烷 D.丁烷和异丁烷
7.下列说法正确的是
A.酸与碱发生中和反应所放出的热量称为中和热
B.1mol甲烷与Cl2发生取代反应生成CCl4,需Cl2 2mol
C.H2→H+H的变化需吸收能量
D.1mol蔗糖水解可生成2mol葡萄糖
8.聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好,不易老化、耐擦洗、
![]() 色泽亮丽等优点。聚丙烯酸酯的结构简式可表示为
,由丙烯酸酯加聚得到。
色泽亮丽等优点。聚丙烯酸酯的结构简式可表示为
,由丙烯酸酯加聚得到。
下列关于聚丙烯酸酯的说法不正确的是
A.属于高分子化合物 B.链节为-CH2—CH—
C.单体为CH2=CH—COOR D.n为聚合度
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正
确的给2分,选两个且都正确的给满分。但只要选错一个,该小题就为0分)
9.据报道,“可燃冰”是水与天然气相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中;
据测定一种“可燃冰”中平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子,
若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充。下列说法中不正确的是
A.“可燃冰”被认为是21世纪新型洁净的能源
B.“可燃冰”可用作化工原料合成氨和生产甲醇等
C.“可燃冰”的形成是水变油的化学变化过程
D.该种“可燃冰”的平均组成可表示为CH4·10H2O
![]() 10.以下有关物质结构的描述正确的是
10.以下有关物质结构的描述正确的是
A. 的分子结构中既含碳碳单键又含有碳碳双键
B.苯分子中的碳碳键是一种介于单键和双键之间的独特的键
C.二氯甲烷分子为正四面体结构
D.乙烷分子中的所有原子均在同一平面内
11.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) ![]() Y(g)+Z(g),
Y(g)+Z(g),
达到反应限度的标志是
A.X的分解速率与X的生成速率相等 B.反应容器中压强不再变化
C.X、Y、Z的浓度不再变化 D.单位时间内生成lmolY的同时生成lmolZ
12.只用一种试剂就可以鉴别乙醇溶液、乙酸溶液、葡萄糖溶液,这种试剂是
A.NaOH溶液 B.新制Cu(OH)2浊液 C.石蕊试液 D.Na2CO3溶液
13.通过实验来验证淀粉水解可以生成葡萄糖,其实验包括下列操作,这些操作的正确顺序是
①加入少量淀粉和水制成溶液 ②加热煮沸 ③加入碱液中和酸
④加入银氨溶液 ⑤加入少量稀硫酸 ⑥再加热
A.①②⑤⑥④③ B.①⑤②④⑥③ C.①⑤②③④⑥ D.①⑥④⑤③②
l4.下列物质中,含有非极性键的共价化合物是
A.CH2=CH2 B.Na2O2 C.I2 D.CH4
15.有两种粒子,它们所含的质子数和核外电子数均相等,则关于这两种粒子的说法不正确的是
A.可能是一种分子和一种离子 B.可能是两种不同的分子
C.可能是一种分子和一种原子 D.可能是互为同位素的两种核素
16.根据相关化学概念和原理,下列判断正确的是
A.若某反应的生成物总能量低于反应物总能量,则该反应为放热反应
B.若A2+2D-=2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若甲、乙两种有机物具有相同的分子式,不同的结构,则甲和乙一定是同分异构体
17.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
下列描述正确的是
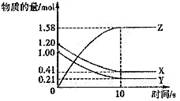 A.反应开始到10s,用Z表示的反应速率为
A.反应开始到10s,用Z表示的反应速率为
0.158moL/(L·s)
B.l0 s后,该反应停止进行
C.反应的化学方程式为:X(g)+Y(g)![]() 2Z(g)
2Z(g)
D.反应开始到l0s时,平均反应速率
ν(X)=ν(Y)=0.0395mol/(L·s)
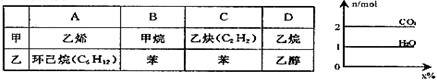
18. 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成
CO2、H2O的物质的量(n)与甲在混合液中的质量分数(x%)关系如右图所示,则甲、乙
组合正确的是
三、(本题包括3小题,共28分)
19.(9分)写出下列反应的化学方程式(有机物以结构简式表示),并注明反应类型。
(1)乙烯使溴水褪色
(2)由苯制取硝基苯
(3)乙醇制乙醛(CH3CHO)
20.(12分)元素周期表是学习化学的重要工具,它隐含许多信息和规律。
下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)。
(2)B元素处于周期表中 周期 族;
(3)在元素周期表中 的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(5)用电子式表示A、D形成化合物的过程 ;
(6)C、E形成化合物为 (填化学式),含化学键类型为 。
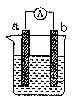 21.(7分)右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
21.(7分)右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,
正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置 (填“能”或“不能”)形成原电池,若不能,请说明
理由,若能,请指出正、负极
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解
液;则甲烷应通入 极(填a或b,下同),电子从 极流出。
四、(本题包括2小题,共王8分)
22.(6分)下列物质的转化或分离是用哪种方法实现的?
A.溶解 B.裂解 C.分馏 D.裂化 E.干馏 F.蒸馏 G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
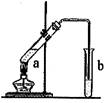 23.(12分)可用图示装置制取少量乙酸乙酯,请填空:
23.(12分)可用图示装置制取少量乙酸乙酯,请填空:
(1)试管a中需加入浓硫酸、乙酸和乙醇各2mL,正确的加入顺序与操作是:
为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是:
(2)写出a中反应的化学方程式,并注明反应类型
、
(3)实验中加热试管的目的是:
①
②
(4)试管b中装有饱和Na2CO3溶液,其作用是(填字母编号)
A.中和乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)试管b中的导管未插入液面下,原因是:
若要把试管b中制得的乙酸乙酯分离出来,应采用的实验操作是
五、(本题包括1小题,共8分)
24.(8分)铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该
铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积
关系如下表(气体体积均在标准状况下测定)。
| ① | ② | ③ | |
| 铝热剂质量/g | 7.5 | 15.0 | 20.0 |
| 气体体积/L | 3.36 | 6.72 | 6.72 |
计算: (1)NaOH溶液物质的量浓度
(2)该铝热剂中铝的质量分数
(3)15g该铝热剂发生铝热反应理论上产生铁的质量。
高一化学试题参考答案及评分标准
一(每小题2分,共16分)、二(每小题3分,共30分)选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 | C | D | B | A | C | B | C | B |
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | CD | B | AC | B | C | A | A | AD | CD | C |
三、(本题包括3小题,共28分)
19、(方程式2分,类型1分,共9分)
(1)CH2=CH2+Br2![]() CH2Br-CH2Br 加成反应
CH2Br-CH2Br 加成反应
![]() (2) +HO-NO2
(2) +HO-NO2![]() +H2O 取代(或硝化)反应
+H2O 取代(或硝化)反应
(3)2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
(或CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
氧化反应)
CH3CHO+Cu+H2O
氧化反应)
20、(共12分)
(1)(全对为3分,错一个扣1分,不出现负分,写元素符号的为0分)
| E | |||||||||||||||||
| A | B | C | D | ||||||||||||||
(2)第三 第ⅢA (2分)
(3)金属与非金属 (1分)
(4)HClO4 (1分)
![]()
(5) (2分)
(6) SO2、SO3 (2分,对一个得1分) 极性键(或共价键) (1分)
21、(共7分)
(1) 2H++2e-=H2↑ (2分)
(2)能 (1分) Mg(或b)为正极 Al(或a)为负极 (2分)
(3) b b (2分)
四、(本题包括2小题,共王18分)
22、(每空1分,共6分)
(1)E (2)C (3)F (4)H (5)G (6)I
23、(共12分)
(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸 (2分)
(如在试管a中最先加入浓硫酸,此题得0分)
在试管a中加入几粒沸石(或碎瓷片) (1分)
(2)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 酯化(或取代)反应 (3分)
(3) ①加快反应速率 (1分)
②及时将产物乙酸乙酯蒸出,以利于平衡想生成乙酸乙酯的方向移动 (1分)
(4) BC (2分)
(5)防止倒吸 (1分) 分液 (1分)
五、(本题包括1小题,共8分)
24、(8分)
解:(1) 由③知:NaOH溶液不足 (Al过量)
根据反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
n(NaOH) = n(H2) = × = 0.1mol (1 分)
c (NaOH) = = 2mol·L-1 (1分)
(2) ①中NaOH溶液过量 (Al不足)
则n (Al) = n (H2) = × = 0.1mol
m (Al) = 27g·mol-1×0.1mol = 2.7g (2分)
Al% = ×100% =36% (1分)
(3) 15g该铝热剂中含铝:15g×36% = 5.4g Fe2O3:15g-5.4g = 9.6g
根据铝热反应:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
可以判断出铝过量,Fe2O3全部被还原生成Fe (2分)
m(Fe) = ×2×56g·mol-1 = 6.72g (1分)
答:略。(其他合理解法可酌情给分)