高一化学第一学期期中考试
高 一 化学
命题人:杨德义
原子量:H:1 O:16 C:12 N:14 Na:23 S:32 Mg: 24 Al: 27 Cu: 64 Fe:56
注意:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共6页,37道题。
满分值:100分,考试时间:90分钟。考生只交第Ⅰ卷答题卡和第Ⅱ卷。
第Ⅰ卷(选择题,共60分)
一、选择题(每小题只有一个选项符合题意,30小题,每小题2分,共60分)
1.对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是




A. B C. D
2.下列反应中必须加入还原剂才能进行的是
A.Cl2→Cl- B.Zn→ Zn2+ C.H2→H2O D.CuO→CuCl2
![]() 3.下列仪器常用于物质分离的是
3.下列仪器常用于物质分离的是
![]()
![]()
![]()
![]()
![]() ① ② ③ ④ ⑤
⑥
① ② ③ ④ ⑤
⑥
A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
4.氯化铁溶液和氢氧化铁胶体具有的共同性质是
A. 分散质粒子直径都在1-100nm之间 B. 都能通过半透膜
C. 都能通过滤纸 D. 都呈红褐色
5.在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+ 、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42- D.Fe3+、Na+、Cl-、SO42-
6.选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是B
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
7.鉴别SO42-时所选用的试剂及顺序最合理的是
A.稀盐酸、BaCl2溶液 B.稀硝酸、BaCl2溶液
C.Ba(NO3)2溶液、稀盐酸 D.BaCl2溶液、稀盐酸
8.实验室进行NaCl蒸干时,一般有以下操作过程:①放置酒精灯;②固定铁圈位置;③放置蒸发皿;④加热搅拌;⑤停止加热,余热蒸发。其正确的操作顺序为
A.②③④⑤① B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
9.一定温度和压强下,2体积AB2(气)和1体积B2(气)化合生成2体积气态化合物,则该化合物的化学式为
A.AB3 B.AB2 C.A3B D.A2B3
10.下列溶液中含Cl-物质的量浓度最大的是
A.30mL0.2mol/LKCl溶液 B.20mL0.1mol/LCaCl2溶液
C.10mL0.1mol/LAlCl3溶液 D.100mL0.25mol/LNaCl溶液
11.关于反应C+CO2=2CO,下列说法正确的是
A.是化合反应,不是氧化还原反应
B.CO既是氧化产物又是还原产物
C.单质C中C的化合价升高,被还原,是氧化剂
D.CO2中C的化化合价降低,被氧化,CO2是还原剂
12.下列反应中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( ) B
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑(Na2O2中氧元素为-1价)
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
13.对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加。其中正确的是
A.①③ B.③ C.①② D.③④
14.刚刚过去07年10月24日我国成功发射常娥探月卫星,它是以液氢液氧为燃料,产物为水,不会产生环境污染,下列对该反应说法正确的是
A.液氢做还原剂, 液氧做氧化剂,水只是氧化的产物.
B.液氢做氧化剂, 液氧做还原剂,水只是还原剂产物.
C.液氢发生还原反应,液氧发生氧化反应,水既是氧化产物又是还原剂产物
D.液氢发生氧化反应,液氧发生还原反应,水既是氧化产物又是还原剂产物
15.下列说法正确的是A
A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离
B.强电解质与弱电解质的本质区别,是其水溶液导电性的减弱
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是非电解质
16.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
17.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
18.下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.标准状况下,1 mol任何物质体积均为22.4L.
C.3.01×1023个Cl2分子的质量为35.5g D.CH4的摩尔质量为16g
19.下列反应的离子方程式正确的是BD
A.氨气通入醋酸溶液 CH3COOH+NH3 == CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH- == H2O
C.碳酸钡溶于醋酸 BaCO3+2H+ == Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+2H2O == Na++2OH-+H2↑
20.下列离子方程式改写成化学方程式正确的是
A.Cu2++2OH-![]() Cu(OH)2↓ CuCO3+2NaOH
Cu(OH)2↓ CuCO3+2NaOH![]() Cu(OH)2↓+Na2CO3
Cu(OH)2↓+Na2CO3
B.CO![]() 十2H+
十2H+![]() CO2↑十H2O BaCO3+2HCl
CO2↑十H2O BaCO3+2HCl![]() BaCl2+C02↑十H20
BaCl2+C02↑十H20
C.Ca2++CO![]()
![]() CaCO3↓ Ca(NO3)2+Na2CO3
CaCO3↓ Ca(NO3)2+Na2CO3![]() CaCO3↓+2NaNO3
CaCO3↓+2NaNO3
D.H++OH-![]() H20
Ba(OH)2+H2SO4=BaSO4↓十2H20
H20
Ba(OH)2+H2SO4=BaSO4↓十2H20
21.能用H++OH-=H2O来表示的化学反应是
A.氢氧化镁和稀盐酸反应 B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应 D.二氧化碳通入澄清石灰水中
22.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
由上述现象可推知a、b、c、d依次是
A.HCl、BaCl2、AgNO3、Na2CO3 B.AgNO3、HCl、Na2CO3、BaCl2
C.BaCl2、Na2CO3、 AgNO3、HCl D.AgNO3、HCl、BaCl2、Na2CO3
23.实验中的下列操作正确的是
A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量试剂倒入试剂瓶中
B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C、用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
24.已知在等温、等容条件下,气体的物质的量与压强成正比。同温、同体积、同质量的CO2、N2、H2、O2的四种气体,按压强由大到小的顺序排列,正确的是
A.H2>O2>N2>CO2 B.CO2>O2>N2>H2
C.H2>N2>O2>CO2 D.CO2>H2>O2>N2
25. 设阿伏加德罗常数为NA,则下列说法正确的是
A. 甲烷的摩尔质量为16克
B. 标准状况下,0.3molSO2中含氧原子数为0.3NA
C. 常温下,2.7克铝与足量的盐酸反应,失去的电子数为0.3 NA
D. 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA
26.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A、abc B、bcd C、abd D、abcd
27.某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
28.用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
CA、3∶2∶2 B、1∶2∶3 C、1∶3∶3 D、3∶1∶1
29.欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
30.已知氨水密度为0.990 g/mL时,NH3的质量分数为2%,氨水的密度为0.930 g/mL时,NH3的质量分数为18%,溶质质量分数分别为a%和5a%的氨水按等体积混合,混合溶液中NH3的质量分数为
A.3 a% B.6 a% C.> 3 a% D.< 3 a%
第Ⅱ卷(选择题,共40分)
二、填空题
31.(6分)混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?
a、精制胶体 b、分离豆浆和豆渣
c、除去水中的沙子 d、用海水晒盐
e、海水淡化 f、从溴水中提取溴
32.(共6′)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
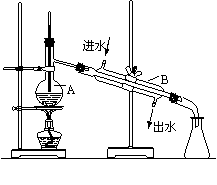 ⑴ 图中有两处明显的错误是
⑴ 图中有两处明显的错误是
① ;
② 。
⑵ A仪器的名称是 ,B仪器
的名称是 。
⑶ 实验时A中除加入少量自来水外,还需要加
入少量的 ,其作用是 。
33.(4分)配制500mL1.0mol/L的NaCl溶液时,下列操作会使实际浓度偏高,偏低还是不变,请填:
(1).摇匀后,液面低于刻度线,没有再加水;
(2).移液过程中,不小心溅出少量溶液;
(3).配制用的NaCl固体不纯净;
(4).定容时,俯视刻度线;
34.(8分)
同温同压下,同体积的H2和CO2物质的量之比为___________,分子个数之比________,原子个数之比__________,质量比___________;
同温同压同质量的H2和CO2物质的量之比为__________,分子个数之比________,原子个数之比__________,体积比为_______________。
35.(6分)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:(5分)
____________;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,
原因是: _______________________;
此时最好用含氢氧化铝的胃药(如胃舒平)
离子方程式: _________ 。
36.(4分)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:
B组:
三、计算题
37.(6分)状准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,
(1)求所得盐酸的物质的量浓度?
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度?
(3)将(2)的溶液取出250mL与足量的Zn反应可以产生多少体积的H2(在标准状况下) ?
参考答案
第Ⅰ卷 (选择题答题卡60分)
一、选择题(本题每小题2分,共60分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | A | B | C | B | B | A | B | A | C | B | B | B | D | A |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | A | B | C | B | C | C | D | D | C | C | D | A | C | B | D |
第Ⅱ卷(选择题,共40分)
31.(6分)a、渗析 b、过滤 c、过滤 d、蒸发结晶 e、蒸馏 f、萃取
32. (共6′) ⑴①温度计水银球插入太深(1′);②冷却水进出口标反了(1′);
⑵蒸馏烧瓶(1′),冷凝管(1′); ⑶沸石(或碎瓷片)(1′),防止液体暴沸(1′)
33.(4分)不变,偏低,偏低,偏高
34.(8分)1:1 、 1:1 、 2:3 、1:22、22:1、22:1、44:3、22:1
35.(6分)HCO3-+H+=CO2↑+H2O;
因产生CO2压力增大而加剧胃壁穿孔;
Al(OH)3+3H+=Al3++3H2O;
36.(4分) A组Cu2+ H+ Cl- NO3- B组Na+ K+ OH- CO3-
37.(6分)解:(1) 4 mol·L-1 (2分) (2)1 mol·L-1 (2分)
(3) 2.8 mol (2分)