高一化学第一学期期中考试卷
|
说明:1、请将答案填写在答案卷上,考试结束后只交答案卷。
2、考试时间:60分钟; 本卷满分:100分+10分
可能用到的相对原子质量: H—1 O—16 Na—23 S—32 Cl—35.5
第一卷 (选择题 共45分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1.能区分胶体和溶液的方法是( )
A.静置,有沉淀现象的是胶体 B.有丁达尔现象的是胶体
C.能透过滤纸的是溶液 D.用肉眼观察,均匀透明的是溶液
2.下列物质间不能发生反应的是( )
A. H2SO4和Ba(OH)2
B. CO2和NaOH
C. CaCO3和HCl D. Mg(OH)2和CuSO4
3.下列各组物质中,依次属于单质、酸、盐的一组是( )
A.干冰、石灰石、氧化钙 B.氧气、盐酸、熟石灰
C.水、烧碱、食盐 D.液氯、硝酸、纯碱
4.下列说法正确的是( )
A.金属钠能与NaOH溶液反应
B.金属钠露置于空气中易被氧化生成Na2O2
C.金属钠能置换出盐溶液中不活泼的金属单质
D.金属钠着火可用水来灭火
5.![]() He 可以作为核聚变材料,下列关于
He 可以作为核聚变材料,下列关于![]() He的叙述正确的是( )
He的叙述正确的是( )
A. ![]() He 和
He 和![]() H 互为同位素
B.
H 互为同位素
B. ![]() He 原子核外电子数为2
He 原子核外电子数为2
C. ![]() He 原子核内中子数为2 D.
He 原子核内中子数为2 D. ![]() He 代表有2个质子和3个中子的氦原子
He 代表有2个质子和3个中子的氦原子
6.下列说法错误的是( )
A.化合反应不一定是氧化还原反应
B.置换反应一定是氧化还原反应
C.氧化还原反应中,非金属单质一定是氧化剂
D.氧化还原反应中,金属单质一定是还原剂
7.下列关于氯水的叙述正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.光照氯水有气泡放出,该气体是Cl2
C.氯水放置一段时间后颜色将变深
D.新制氯水可使紫色石蕊试液先变红后褪色
8.下列反应中,硫元素只被氧化的是( )
A.SO2+2H2S===3S↓+2H2O B.SO3+H2O==H2SO4
C.SO2+2H2O+Br2===2HBr+H2SO4 D.3S + 6KOH = K2SO3 + 2K2S + 3H2O
9. 能鉴别NH4Cl、K2SO4、(NH4)2SO4、NaCl四瓶无色溶液的试剂是( )
A. Ba(NO3)2溶液 B.AgNO3溶液 C. Ba(OH)2溶液 D. NaOH溶液
10.现有三组溶液:①CCl4和氯化钠溶液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合物(苯和甲苯是其他性质非常相似的一对互溶液体);③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.蒸馏、萃取、分液 D.分液、蒸馏、萃取
11.能使湿润的淀粉KI试纸变蓝的是( )
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾
A.①②③ B.①②④ C.②③④ D.③④⑤
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2L N2含有的分子数为0.5NA
B.在常温常压下,18 g水中含有的分子数为NA
C.含有分子数为NA的氧气的质量是16g/mol
D.在 2mol/L的MgCl2溶液中含有的Cl- 数为4 NA
13.有下列物质:①0.5mol NH3 ②标准状况下22.4L He ③4℃时9mL H2O ④0.2mol H3PO4 按所含的原子数由多到少的顺序排列,正确的是( )
A、①④③② B、④③②① C、②③④① D、 ①②③④
14.配制一定体积一定物质的量浓度溶液时,下列情况对实验结果产生偏高影响的是( )
A.定容时仰视刻度线
B.容量瓶中还有蒸馏水时即配溶液
C.定容时液面高于刻度,用滴管小心吸去多余液体,使液面与刻度相切
D.定容时俯视刻度线
15.把4.6g钠投入到95.6g水中,发生化学反应。假设水无蒸发现象,所得溶液中溶质的质量分数是( )
A.4.6% B.7.7% C.10% D.8.0%
第二卷 非选择题(共55分)
| |
16.(5分)解释钠与水反应的实验现象的原因有:
A.钠与水界面各部分产生H2的量不同,所受推力不均匀;
B.钠的密度比水小;
C.钠与水反应放热,使熔点低的钠熔化成小球;
D.钠不断与水反应;
E.生成的氢氧化钠使酚酞试液变红。
请在下表填写与描述的现象相对应的原因。
| 实验现象 | 原因(填以上序号) |
| 钠浮在水面上 | |
| 熔成闪亮的小球 | |
| 小球向各个方向迅速游动,并发出“嘶嘶”的声音 | |
| 小球逐渐变小最后完全消失 | |
| 在反应后的溶液中滴入酚酞试液显红色 |
17.(13分)下图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图:
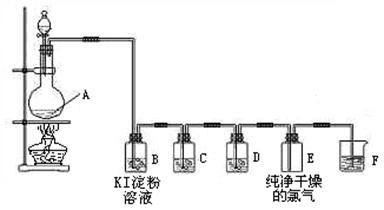
(1)装置A中所发生反应的化学方程式是 。 若反应过程转移的电子的物质的量为0.4mol,则生成的Cl2体积(标准状况)为 升。
(2)装置B中的现象是 ,反应的化学方程式为 。
(3)装置C中所装试剂是 ,作用是 。
(4)装置D中所装试剂是 ,作用是 。
(5)装置F中发生反应的化学方程式为 。
三.填空题(本题共28分)
18.(8分)用单线桥法标明下列氧化还原反应中电子转移的情况,注明氧化剂和还原剂:
(1) 2NaCl + 2H2O ![]() 2NaOH +
H2↑+ Cl2↑
2NaOH +
H2↑+ Cl2↑
(2) 3Cu + 8HNO3(稀) === 3Cu(NO3)2 + 2NO↑ + 4H2O
19.(6分)今有七种物质: ①铝线 ②熔化的KNO3 ③氯气 ④NaCl晶体
⑤液态氯化氢 ⑥石灰水 ⑦乙醇
其中能导电的物质是 ,属于电解质的是 ,属于非电解质的是 。
20.(14分)试回答下列问题:
(1)3.01×1023个氨分子含__________mol氨分子,____________mol氢原子,
____ ___摩尔质子,_______________个电子。
(2)等物质的量的SO2和SO3所含的原子个数之比是____ __,质量比是_____ __。
(3)0.4mol NH3中所含氢原子数与____ ____克水中所含氢原子数相等。
四、计算题(本题共9分)
21.(9分)
(1)现用氯化氢气体溶于水制取盐酸,要配制6mol/L的盐酸250mL,需要标准状况下的氯化氢气体多少升?
(2)取上述所配制的6mol/L盐酸100 mL与足量石灰石完全反应后,可生成标准状况下多少升二氧化碳?
(3)若已知6mol/L盐酸的密度为1.1 g/cm3,则该盐酸的质量分数为多少?
五、附加题(本题共10分)
22.(5分)在一个密闭容器中用一可移动板隔开,左边充有氮气,右边充入H2、O2。
在室温下用电火花点燃混合气体,反应后仍冷却至室温,隔板终止于容器中点,
则原混合气体中H2、O2的体积比是( )
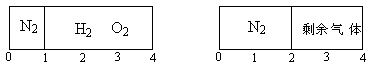 A.2:7 B.7:2
A.2:7 B.7:2
C.4:5 D.8:1
23.(5分)今有Cl2和H2的混合气体aL(标况下),点燃使之充分反应,将所得气体通入含有过量苛性钠的溶液中,最后得盐bmol,则b值范围(用a表示) 。
高一化学第一学期期中考试卷
高一化学参考答案
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1.B 2.D 3.D 4.A 5.B 6.C 7.D 8.C 9.C 10.D 11.A 12.B 13.A 14.D 15.D
二、实验题(本题共18分)
16. (5分)
| B |
| C |
| A |
| D |
| E |
17.(13分)(1)4HCl+MnO2![]() MnCl2+2H2O+Cl2↑
4.48升。
MnCl2+2H2O+Cl2↑
4.48升。
(2) 溶液变蓝,Cl2+2KI=2KCl +I2 。
(3) 饱和食盐水,吸收HCl气体。
(4) 浓硫酸,吸收H2O干燥氯气。
(5) Cl2+2NaOH=NaCl+NaClO+H2O 。
三.填空题(本题共28分)
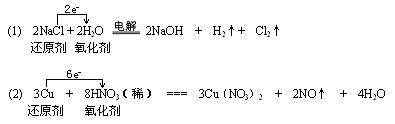 18.(8分)
18.(8分)
19.(6分) ①②⑥; ②④⑤; ⑦。
20.(14分)(1)0.5mol , 1.5mol , 5 , 3.01×1024 (2)3:4 4:5 (3)10.8
四、计算题(本题共9分)
21.(9分)(1)33.6L (2)6.72L (3)19.9%
五、附加题(本题共10分)
22.(5分) BC 23.(5分)0<b<a/11.2mol