![]()

 高一化学第一学期期中考试试卷
高一化学第一学期期中考试试卷
高一化学
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 Br:80 Na:23 Al:27 K:39 Fe:56 Cu:64 Ca:40
一、选择题(本题包括20小题,每小题2分,共40分,每小题只有一个选项符合题意)
( )1.对危险化学品要在包装标签上印上警示性标志。下列化学品名称与警示标志名称对应正确的是
A .酒精—剧毒品 B.浓硫酸—腐蚀品 C.氯化钠—易燃品 D.烧碱—剧毒品
( )2. 如图所示,下列实验操作与方法正确的是
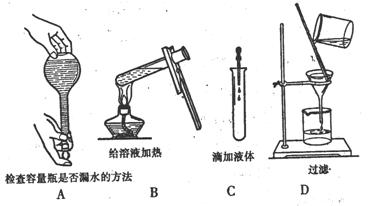
( )3.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A.加入过量的碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量的碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
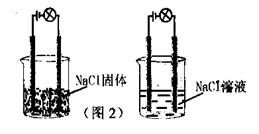 (
)4.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
(
)4.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质。
C.NaCl在水溶液中电离出可以自由移动的离子。
D.NaCl溶液中水电离出大量的离子
( )5. 下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。
B.蒸馏时,温度计水银球应浸没在液体中。
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D.把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体。
( )6.配制物质的量浓度的溶液,不可能使用的仪器是
A.玻璃棒 B.量筒 C.烧杯 D.烧瓶
( )7.除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是
A.Na2CO3、AgNO3、HNO3 B.AgNO3、Na2CO3、HCl
C.AgNO3、Na2CO3、HNO3 D.AgNO3、K2CO3、HNO3
( )8.下列操作中,不用玻璃棒的是
A.过滤 B.蒸发 C.蒸馏 D.溶解
( )9.下列说法中正确的是
A.物质的量就是物质的质量
B.阿伏加德罗常数就是6.02×1023
C.物质的摩尔质量等于该物质的相对分子质量(或相对原子质量)
D.科学上把含有6.02×1023个粒子的任何粒子集体计量为1摩尔
( )10.下列说法正确的是
A.1 mol O的质量是16g/mol B.Na+的摩尔质量是23 g/mol
C.CO2的摩尔质量是44 D.氢的摩尔质量是2 g/mol
( )11.下列判断正确的是
A.1L硫酸溶液中含98gH2SO4,则该溶液的物质的量浓度为98g/L
B.1L水溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L
C.1000mLC12H22O11(蔗糖)溶液里含1mol C12H22O11,则该溶液的物质的量浓度为0.001mol/L
D.10mL 1mol/L的硫酸溶液与100mL 1mol/L的硫酸溶液的浓度相同。
( )12.下列不存在丁达尔效应的分散系是
A.有尘埃的空气 B.氢氧化铝胶体
C.CuSO4溶液 D.向沸水中滴入FeCl3饱和溶液所得液体
( )13.下列各组物质分类正确的是
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫酸 | 纯碱 | 石膏 | 铁红 |
| B | 盐酸 | 烧碱 | 纯碱 | 生石灰 |
| C | 碳酸 | 熟石膏 | 小苏打 | 干冰 |
| D | 干冰 | 苛性钾 | 食盐 | 石灰石 |
( )14. 下列物质属于电解质的是
A.石墨 B.烧碱 C.蔗糖 D.金属铝
( )15. 黑火药的爆炸反应 :2KNO3+S+3C == K2S+N2↑+3CO2↑ ;其中被氧化的元素是:
A.N B. S C. O D.C
( )16. 在某无色酸性溶液中能大量共存的一组离子是
A.Na+ 、K+ 、HCO3— 、NO3— B.NH4+ 、SO42— 、Al3+ 、NO3—
C.Na+ 、Ca2+ 、NO3— 、CO32— D. K+、MnO4— 、NH4+ 、NO3—
( )17.下列离子方程式书写正确的为
A.氯化钡溶液与稀硫酸混合:Ba2+ + SO42— = BaSO4↓
B.铁与盐酸反应:Fe + 2H+ = Fe3+ + H2↑
C.氧化铜与硫酸反应:Cu2++SO42— = CuSO4
D.氢氧化钡溶液与稀硫酸混合:Ba2+ + SO42— = BaSO4↓
( )18. 能正确表示四种基本类型反应与氧化还原反应关系的示意图是

A B C D
( )19.下列反应属于氧化还原反应的是
A.2H2S+SO2===3S↓+2H2O B.CaCO3+H2O+CO2=== Ca(HCO3)2
![]() C.CuO + 2HCl = CuCl2 + H2O
D.CaCO3===CaO + CO2↑
C.CuO + 2HCl = CuCl2 + H2O
D.CaCO3===CaO + CO2↑
( )20.P单质在反应4P + 3KOH + 3H2O = 3KH2PO2 + PH3中的变化是
A.被氧化 B.被还原 C.既被氧化又被还原 D. 既不被氧化又不被还原
( )21、苹果汁是人们喜爱的饮料。由于饮料中含有 ![]() 离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使
离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使![]() 转变为
转变为![]() 离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有:
离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有:
A 氧化性 B 还原性 C 酸性 D 碱性
( )22、根据广州中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A、溶液 B、悬浊液 C、乳浊液 D、胶体
![]()
 高一化学第一学期期中考试试卷
高一化学第一学期期中考试试卷
高一化学
一、选择题答题卡:(每题2分,共44分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
二、填空题(本题共6小题,每空2分,共36分)
23.欲除去碳酸钙粉末中混有的少量碳酸钠粉末,可采用的主要操作是________和____________。
24.乙醇(俗名酒精)的结构简式为CH3CH2OH,其分子式为C2H6O,相对分子质量为______________,摩尔质量为_____________。92g乙醇的物质的量为____________,配制成500mL溶液的物质的量浓度为_______________,取出5mL该溶液即取出了_____________个乙醇分子。
25.实验室用自来水制取蒸馏水时:在_____________中加入约____________的自来水,再加入几粒____________,其作用是防止加热时出现____________________。使用的玻璃仪器中,_______________的作用是将_______________冷却成液态水。
26.写出Al2(SO4)3在水溶液中的电离方程式:
_________________________________________________________
27.已知铜在常温下能被稀HNO3溶解,反应为:
3Cu+8HNO3===3Cu(NO3)2+2NO↑十4H2O。
①请将上述反应改写成离子方程式 。
②上述反应中,氧化剂是 。
28.写出下列离子方程式对应的一个化学方程式:
(1)2H+ + CO32— = H2O + CO2↑
________________________________________________________________
(2)Ba2+ + SO42— = BaSO4↓
_________________________________________________________________
三、探究实践题(本题有2小题,共14分)
29、用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:
(1)需取浓硫酸___________ ml(保留小数点后一位数字)
(2)配制操作可分解成如下几步:
A 向容量瓶中注入少量蒸馏水,检查容量瓶是否漏水
B 用少量蒸馏水洗涤烧杯,将溶液注入容量瓶,并重复操作两次
C 将已冷却的硫酸注入容量瓶中
D 根据计算,用量筒量取一定体积的浓硫酸
E 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F 盖上容量瓶塞子,振荡,摇匀,装瓶
G 用胶头滴管继续加蒸馏水,使溶液凹面恰好与刻度相切
H 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
正确的操作顺序是:__________________________
30.(7分)有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:
(1)将固体粉末溶于水得无色溶液和白色沉淀;
(2)加入稀盐酸,沉淀部分溶解且有气泡产生。
根据以上实验所产生得现象,判断这种混合物里,一定含有______________________________物质,一定没有____________物质,可能有的物质是____________。写出上述所发生反应的离子方程式。
________________________________________________________________
_________________________________________________________________
四、计算题(本题有2小题,每空2分,共6分)
31、20克NaOH固体的物质的量是:____________,把其溶于水配成100mL溶液,所得溶液的物质的量浓度为_______________。
32、0.4g氢氧化钠恰好与10ml的盐酸完全反应,试求这种盐酸的物质的量浓度是________________
高一化学第一学期期中考试试卷
高一化学 参考答案
一、选择题答题卡:(每题2分,共44分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| B | A | D | C | B | D | C | C | D | B | D |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| C | B | B | D | B | A | D | A | C | B | D |
二、填空题(本题共6小题,每空2分,共36分)
23、溶解 过滤 24、46,46g/mol, 2mol, 4mol/L, 1.204×1022
25、烧瓶、1/3体积、沸石(或碎瓷片)、暴沸、冷凝管、水蒸气
26、Al2(SO4)3=2Al3++3SO42—
27、①3Cu+8H+ + 2NO3—===3Cu2+ +2NO↑十4H2O,②HNO3
28、(1)2HCl+Na2CO3=NaCl+H2O+CO2↑ (2)BaCl2+H2SO4=BaSO4↓+2HCl(其它符合题意亦给分)
三、探究实践题(本题有2小题,共14分)
29、(1)5.0ml (2) A D E C B G H F
30、Na2SO4、CaCO3、BaCl2 ; CuSO4 ; KCl
离子方程式:Ba2+ + SO42— = BaSO4↓、CaCO3+2H+=Ca2++H2O+CO2↑
四、计算题(本题有2小题,每空2分,共6分)
31、0. 5mol 5 mol/L 32、1mol/L