高一化学第一学期期中考试试卷
化 学 试 卷
卷Ⅰ(选择题,共50分)
可能用到的原子量Na:23 H:1 O:16 Cl:35.5 I:127 C:12
一、单项选择题(每题只有1个正确答案,每小题2分,共20分)
1.下列叙述正确的是( )
A.氧化还原反应的本质是电子的转移
B.还原剂是在反应中得电子的物质
C.还原剂在反应中发生还原反应
D.置换反应不一定都是氧化还原反应
2.下列物质:①NaCl②HNO3③CO2④KOH⑤AgNO3⑥H2O⑦CH 4⑧H2CO3⑨蔗糖⑩酒精,其中属于弱电解质的是( )
A . ⑥⑧ B . ③⑤⑧ C . ③⑨⑩ D . ③⑥⑧
3. 下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
4.下列离子方程式正确的是( )
A . 石灰石和盐酸反应 2 H + + CO 32- = CO 2↑+ H 2 O
B . 过量的二氧化碳气体通入碳酸钠溶液 CO 2 + CO 32-+ H 2 O = 2 HCO 3-
C . 小苏打溶液中加入烧碱溶液 HCO 3-+ OH - = CO 2↑+ H 2 O
D . 小苏打溶液中加入醋酸 HCO 3-+ H + = CO 2↑+ H 2 O
5.将4.6g金属钠投入到95.4g水中,所得溶液中溶质的质量分数( )
A.等于4.6% B.等于8%
C.小于8% D.大于8%
6.将过量CO2通入到下列物质的溶液中,最终会有沉淀生成的是( )
A.NaOH稀溶液 B.饱和Na2CO3溶液
C.饱和NaHCO3溶液 D.饱和NaCl溶液
7. 镁条在空气中燃烧后得到的生成物是( )
A.只有MgO B.只有Mg3N2 C.Mg3N2和MgO D.MgCO3
8.下列变化过程中不能直接实现的是( )
①HCl ②Cl2 ③Ca(ClO)2 ④HClO ⑤CO2
A.①→② B.②→③ C.③→④ D.④→⑤
9. 下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里常以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的盐溶液中还原出来
D.钠和钾的合金在室温下呈液态,可作原子反应堆的导热剂
10.在10mL 0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后,在标准状况下产生二氧化碳的体积为:( )
A.1.344mL B.2.24mL C.0.672mL D.0mL
二、多项选择题(每题有1~2个正确选项,每小题3分,共30分)
11.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2 D.氯水放置数天后酸性增强
12. 欲使每10个水分子中溶有1个钠离子,则90mL水中应加入金属钠的质量是( )
A.10.5g B.11.5g C.21g D.23g
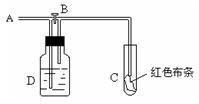 13. 如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是( )
13. 如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是( )
A.D中可以是浓硫酸
B.通入的氯气含有水份
C.D中可以是水
D.D中可以是饱和食盐水
14. 根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O=2HI+H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO ↑+2H2O+Fe(NO3)3
A.H2SO3>Iˉ>Fe2+>NO B.Iˉ>Fe2+>H2SO3>NO
C.Fe2+>Iˉ>H2SO3>NO D.NO>Fe2+>H2SO3>Iˉ
15.在酸性溶液中能大量共存而且为无色透明的溶液是( )
A.NH4+、Al3+、SO42-、NO3- B.K+、Na+、NO3-、CO32-
C.K+、MnO4-、NH4+、NO3- D.Na+、K+、HCO3-、NO3-
16.下列物质的保存方法不正确的是( )
A.钠保存在煤油中
B.盛液溴的试剂瓶中常加少量水
C.氢氧化钠存放在带玻璃塞的试剂瓶中
D.固态碘存放在棕色细口瓶中
17.配制100mL.1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
A.容量瓶使用前经蒸馏水清洗后没有干燥
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.俯视确定凹液面与刻度线相切
D.用敞口容器称量NaOH且时间过长
18.在甲,乙两坩埚中分别盛有等质量的NaHCO3固体,将甲坩埚充分加热后冷却,再加入足量盐酸,乙不经加热也加入足量盐酸,反应完全后,甲,乙两坩埚中实际参加反应的盐酸的质量比为( )
A.2∶3 B.1∶1 C.1∶2 D.2∶1
19.对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
20.在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃后,三种气体正好完全反应,所得溶液中溶质的质量分数为25.26%,则容器中原有的H2、O2、Cl2分子数之比为( )
A.6:3:1 B.9:6:1 C.13:6:1 D.10:6:1
卷Ⅱ(非选择题,共50分)
三、填空题(共26分)
21.用双线桥法分析下面的方程式(每题2分,共4分)
3Br2+6KOH=5KBr+KBrO3+3H2O 3Cu+8HNO3(稀)=3Cu(NO)2+2NO↑+4H2O
22.用单线桥法分析下面的方程式(每题2分,共4分)
![]() 2Na+2H2O=2NaOH+H2↑ 2NaCl+2H2O=====2NaOH+2H2↑+Cl2↑
2Na+2H2O=2NaOH+H2↑ 2NaCl+2H2O=====2NaOH+2H2↑+Cl2↑
23. (每空2分,共6分)Al2O3是两性氧化物,其与盐酸反应的离子方程式为
,与NaOH反应的离子方程式为 。Al(OH)3是两性氢氧化物,其与NaOH反应的化学方程式为 。
24. (每空2分,共6分)把2.24LCO2通入含NaOH 4.8g的溶液充分反应后,其反应产物分别为_______________和________________,其物质的量比为___________________。若再加入盐酸溶液,使所得溶液反应至无气体生成,需加入2mol/L HCl ____________毫升。
25.(每空2分,共6分)请解释钠与水反应时产生的以下几种现象:
①钠浮在水面上, 是因为___________________________________________
②钠熔化成小球, 是因为___________________________________________
③滴入酚酞后溶液显红色, 是因为____________________________________
四、实验题(方程式每空3分,其余每空1分,共14分)
26.下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
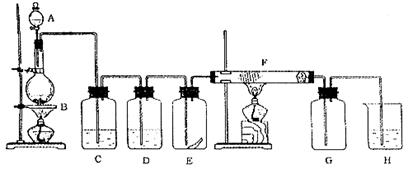
试回答:
(1)A中所放试剂为_______________,B中所放试剂为_____________,二者反应的化学方程式为_____________ _________,该反应中的氧化剂是 ;
(2)为得到干燥纯净的氯气,一般在C瓶中加入 试剂,D瓶中加入 试剂。
(3)E中布条颜色为_______色; F反应的化学方程式为________ 。
(4)H中应加入的试剂为 ,其作用是 。
五、计算题(本题共10分)
27.取NaHCO3和Na2CO3的混合物2.96g,加热到质量不再改变为止时,得到残渣共2.65g。求混合物中Na2CO3的质量。
28.碘化钠和氯化钠的混合物10g,跟足量Cl2反应后,经加热.烘干最后得固体6.64g,求混合物中NaCl的质量分数
化 学 试 卷 参 考 答 案
一、单项选择题
1、A 2、A 3、C 4、B 5、D 6、B 7、C 8、D 9、D 10、D
二、多项选择题
11、BD 12、A 13、AB 14、A 15、A 16、CD 17、C 18、B 19、C 20、C
三、填空题
21、(略)
22、(略)
23、Al2O3 + 6H+ ===Al3+ + 3H2O Al2O3 + 2OH- ===2AlO2- + H2O
Al(OH)3 + NaOH ===NaAlO2 + 2H2O
24、Na2CO3、NaHCO3 1:4 60ml
25、①密度比水小 ②钠熔点低、此反应是放热反应 ③反应后溶液显碱性
四、实验题
26、⑴ 浓盐酸 二氧化锰 MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O 二氧化锰
⑵ 饱和食盐水 浓硫酸
⑶ 红 Cu + Cl2 ===CuCl2
⑷ 氢氧化钠溶液 吸收多余的氯气,防止污染环境
五、计算题
27、2.12g
28、44.9%