高一化学第一学期期中考试试卷
(考试时间:90分钟 满分:100分)
相对原子质量:O----16 H -----1 C-----12 Na----23 S----32
N----14 Cl-----35.5 Al----27
一、 选择题:(每题只有一个正确答案,每小题2分)
1.在国际单位制中,物质的量的基本单位是 ( )
A.千克 B.摩尔 C.克/摩尔 D.摩尔/升
2.同温同压下,相同质量的下列物质所含原子数最多的是 ( )
A.HCl B.NH3 C.H2O D.CH4
3.物质的量相同的两种物质,则它们 ( )
A.微粒数相同 B.质量相同
C.体积相同 D.摩尔质量相同
4.下列各组气体,分子数不一定相同的是 ( )
A.32克氧气和22.4升氢气 B.1摩尔二氧化碳和32克氧气
C.0.5摩尔二氧化碳和0.5摩尔氢气 D.4克氢气和64克氧气
5.下列叙述中,错误的是 ( )
A.1个碳原子和1个氧原子的质量比是12:16
B.1mol碳原子和1mol氧原子所含原子的个数相同
C.1mol碳原子的质量是12g,所以1mol氧原子的质量是16g
D.1mol任何原子的质量,就是该种原子相对原子质量
6.与9 g水含有相同分子数的二氧化碳在标准状况下的体积是 ( )
A.22.4L B.2.24L C.1.12L D.11.2L
7.在同温同压下,A、B容器中分别充满氢气和氨气,如果它们所含的原子总数相等,则着两只容器体积比是 ( )
A.2:1 B.1:2 C.2:3 D.1:3
8.与22.4升氢气完全反应,需氧气 ( )
A.相同状况下11.2L B.相同状况下16g
C.任何状况下0.5mol D.标准状况下11.2L
9.在同温同压下,下列气体密度最小的是 ( )
A.CO2 B.N2 C.O2 D.NO
10.下列有关2mol/ L 氢氧化钠溶液的叙述,正确的是 ( )
A.把2mol氢氧化钠溶于1 L水中配制而成
B.把80 g氢氧化钠溶液配成的1 L溶液
C.把40 g氢氧化钠固体溶于水,配成500m L溶液
D.把40 g氢氧化钠溶成的1 L溶液,蒸发去500 g水
11.500m L2mol/ L氯化钠溶液中取出50 m L,其中所含氯化钠的物质的量是 ( )
A.0.1mol B.0.2mol C.0.5mol D.1mol
12.下列溶液中,Cl-离子的物质的量浓度最大的是 ( )
A.500m L0.5mol/ LNaCl溶液 B.200m L0.3mol/ L MgCl2溶液
C.100m L0.25mol/ L AlCl3溶液 D.500m L0.5mol/ LHCl溶液
13.除去氯化氢中的水蒸气不可通过 ( )
A.无水氯化钙 B.五氧化二磷 C.浓硫酸 D.碱石灰
14.在11g某化合物X2S中,含S2-离子3.2g,则X的相对原子质量为( )
A.23 B.24 C.39 D.40
15.50m L2mol/ L的硫酸溶液中,加入50 m L水,以下说法正确的是( )
A.混和溶液的物质的量浓度是1mol/ L
B.混和溶液中含有0.2mol的硫酸
C.混和溶液的体积恰好为100 m L
D.无法正确计算混和溶液的物质的量浓度
16.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含的SO42-离子数相同,则所取两溶液的体积比是 ( )
A.1:3 B.3:1 C.3:2 D.2:3
17.下列说法正确的是 ( )
A.1mol 任何气体的体积都是22.4L
B.1mol任何物质在标准状况下所占体积都约是22.4L
C.1mol氯气、水、碘(I2)在标准状况下所含分子数相同
D.在同温同压下,相同质量的氯气和氢气
18.在容量瓶上无需标有 ( )
A.刻度线 B.容量标准 C.浓度 D.温度
19.下列气体在水中溶解度最大的是 ( )
A.HCl B.H2 C.O2 D.CO2
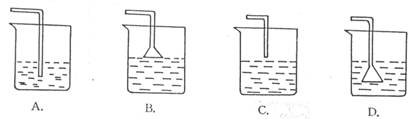 20.实验室用来吸收氯化氢的最好的装置是
( )
20.实验室用来吸收氯化氢的最好的装置是
( )
21.下列关于氯化氢和盐酸的叙述中,正确的是 ( )
A.它们都是纯净物
B.它们在潮湿的空气中都形成酸雾
C.它们都能导电
D.氯化氢是无色气体,盐酸是无色液体,它们都具有刺激性气味
22.下列氯化物不能用金属与盐酸反应得到的是 ( )
① FeCl3 ② FeCl2 ③ CuCl2 ④MgCl2
A.①②③ B.①③ C.②④ D.①④
23.在化学反应2A+B→2C,消耗A与生成C的质量比为5:8,则B与C的摩尔质量比为 ( )
A.3:8 B.3:4 C.8:5 D.3:2
24.下列说法正确的是(NA表示阿佛加德罗常数) ( )
A.在常温常压下,11.2升氯气含有的分子数为0.5NA
B.在常温常压下,1摩尔气含有的原子为NA
C.32g氧气所含原子数目为2NA
D. 在同温同压下,相同体积的任何气体单质所含原子数目相同
25.将0.3mol/ L盐酸100 m L与0.25mol/ L硫酸300m L混合,加水稀释至500m L,冷却,该混合液中H+的物质的量浓度是 ( )
A.0.26mol/ L B.0.36mol/ L C.0.45mol/ L D.0.21mol/ L
二、填空题:(每空2分,共30分)
26.同温同压下,等体积的CO和CO2的物质的量之比________,质量比________,密度比________,所含氧元素的质量比________。
27.同温同压下,等质量的CO和CO2的体积比________,密度比________,所含原子个数比________。
28.将4g氢氧化钠溶于水配制成100 m L的溶液,此溶液的物质的量浓度为________,取出10m L,此10m L溶液的物质的量浓度为________,将10m L溶液加水稀释至250 m L,稀释后溶液的物质的量浓度为________,再取稀释液10m L,用稀硫酸完全中和,需消耗.浓度为0.05 mol/ L稀硫酸溶液________m L。
29.将集满氯化氢气体的试管倒置于滴加紫色石蕊试液的水中,观察到的现象是________________________________________。
30..把生锈的铁钉放入足量的稀盐酸中,反应现象______________________,写出发生反应的化学方程式___________________,______________________。
三、实验题:(每空1分,共10分)
31. 实验室用氢氧化钠固体配1000 m L0.1mol/ L的氢氧化钠溶液,配制过程的正确操作顺序(用①②③……)填写在括号内,并填空:
( )计算所需固体氢氧化钠的质量________克;
( )将称取的固体氢氧化钠放在洁净的烧杯内,加约50─100 m L水,搅拌溶解并冷却至室温;
( )用天平称取所需量的固体氢氧化钠;
( )将溶液移入________中;
( )用蒸馏水洗涤烧杯内壁2─3次,将每次洗液全部移入容量瓶中,摇匀;
( )改用胶头滴管小心滴加蒸馏水至刻度线;
( )继续往容量瓶里加蒸馏水到液面接近刻度线2─3厘米处;
( )加盖瓶塞,反复摇匀;
四、计算题:(32题5分,33题5分,共10分)
32. 在标准状况下,用1升水吸收350升的氨气,所得溶液的密度为0.924g/ cm3,求:
⑴ 氨气的物质的量是多少?
⑵ 溶液的物质的量浓度为多少?
⑶质量百分比浓度是多少?
33.把2.5 g氢氧化钠和氢氧化钾的混合固体溶解于水配成50毫升溶液,取出5毫升恰好跟5.25 毫升1mol/ L的盐酸完全中和,求混合物中氢氧化钠和氢氧化钾各多少克?
答案
一、选择题:(每题只有一个正确答案,每小题2分)
1. B 2. D 3. A 4. A 5. D
6. D 7. A 8. D 9. B 10. C
11. A 12 .C 13. D 14. C 15 .D
16. B 17. C 18. C 19. A 20. B
21 .D 22 .B 23. B 24 .C 25 .B
二、填空题:(每空2分,共30分)
26. 1:1 7:11 7:11 1:2
27. 11:7 7:11 22:21
28.1mol/ L 1mol/ L 0.041mol/ L 4 m L
29.液面上升,溶液变为红色
30.铁锈被除去,金属表面有气泡,溶液由无色变棕黄色
Fe2O3+6HCl→2 FeCl3+H2O Fe+2 HCl →FeCl2+H2
三、实验题:(每空1分,共10分)
31.顺序:①③②④⑤⑦⑥⑧ (填对一空给一分) 4 容量瓶
四、计算题:(32题5分,33题5分,共10分)
32、解:
⑴氨气的物质的量=V/22.4=350/22.4=15.625 mol 1分
⑵ 氨气的质量=15.625*17=265.625 g
溶液的质量=1*1000+15.625*17=1265.625 g 1分
溶液的体积=1265.625/0.924≈1369.7(m L)≈1.3697(L) 1分
溶液的物质的量浓度=15.625/1.3697=11.4 mol/ L 1分
⑶质量百分比浓度=265.625/1265.625*100%≈20.99% 1分
33、解:设NaOH 的物质的量为x mol、KOH的物质的量为y mol
NaOH───HCl KOH───HCl
x mol x mol y mol y mol 1分
![]() 40x+56y=2.5
40x+56y=2.5
x + y=5.25*103*10 2分
![]() x=0.0275
mol
x=0.0275
mol
y=0.025 mol 1分
NaOH的质量=0.0275*40=1.1 g
KOH 的质量=0.025*56=1.4 g 1分
答(略)