高一化学![]()
 第一学期期中考试试卷
第一学期期中考试试卷
说明:1.考试形式:闭卷 试题共五大题29小题,分值:120分,考试时限:100min;2.本卷可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 P :31 S:32 Cl:35.5
一、选择题(本题包括20小题,1~10每小题2分,11~20每小题3分,共50分。每题只有一个选项符合题意,请把答案填入对应的答题卡中。)
1.摩尔(mol)是
A.国际单位制中的一个基本物理量
B.表示物质的质量的单位
C.是计量微观粒子的物质的量的单位
D.表示6.02×1023个数目的集体
2.某同学将浓硫酸、NaOH固体、碱石灰、C12H22O11四种物质中的浓硫酸挑选出来认为与其它可划分为不同类型。该同学的分类依据为
A.溶解度 B.物质的状态 C.气味 D.有机物
3.下列反应不属于氧化还原反应的是
A.2HClO=2HCl+O2 ↑
B.Zn+H2SO4=H2↑+ZnSO4
C.H2+Cl2=2HCl
D.2HCl+Na2CO3=2NaCl+H2O+CO2↑
4.氧化还原反应的实质是
A.电子的得失或偏移 B.元素化合价的升降
C.氧元素的得与失 D.分子里的原子重新组合
5.容量瓶的瓶壁上未标有的是
A.刻度线 B.温度 C.容积 D.浓度
6.下列实验操作中,正确的是
A.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
B.配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.分液时,先将分液漏斗中下层液体放出,然后再将上层液体也从下口放出
7.一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是
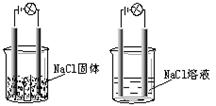 |
A.NaCl固体是非电解质
B.NaCl在水中能电离出可以自由移动的离子
C.NaCl能使溶液中的水电离出大量的离子
D.NaCl溶液是电解质
8.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为
A.单质 B.分子
C.元素 D.氧化物
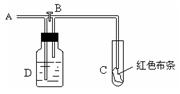 9.如图:A处通入氯气。关闭B阀时,C处干燥的红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断错误的是
9.如图:A处通入氯气。关闭B阀时,C处干燥的红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断错误的是
A.D中盛放的溶液可能是浓硫酸(干燥剂)
B.通入的氯气带有水蒸气
C.D中盛放的溶液可能是NaOH溶液
D.D中盛放的液体可能是水
10.许多元素有多种核素,现仅限以氧的两种核素![]() O、
O、![]() O和氢的两种核素H、D组成水,最多可能有多少种水分子
O和氢的两种核素H、D组成水,最多可能有多少种水分子
A.3种 B.6种
C.9种 D.12种
11.现有三组分散系:①CCl4和NaCl的混合液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合溶液(苯和甲苯是性质非常相似的一对互溶液体);③掺有碘化钾的碘水,分离以上各混合液的正确方法依次是
A.分液、蒸馏、萃取 B.萃取、蒸馏、分液
C.蒸馏、萃取、分液 D.分液、萃取、蒸馏
12.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质能达到此效果的是
A.无水硫酸铜 B.食盐
C.硫酸亚铁或还原铁粉 D. 生石灰
13.下列反应的离子方程式,正确的是
A.金属钠与水的反应:Na + 2H2O = Na+ + 2OH- + H2↑
B.大理石与盐酸反应:CO32-+ 2H+ = CO2↑ + H2O
C.氢氧化钡溶液与稀硫酸反应:Ba2+ + SO42-= BaSO4↓
D.向碳酸钠溶液中通入足量的CO2 :CO2 + CO32- + H2O = 2HCO3-
14.海带中含碘元素,有人觉得按照教材中设计:直接用水浸泡干海带,不如先烧成灰进行处理好。请你按以下几步操作:①通足量氯气 ②将海带烧成灰,向灰中加水搅拌 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液。设计合理的程序
A.②一④一①一③一⑤ B.②一①一③一④一⑤
C.①一③一⑤一②一④ D.③一①一②一⑤一④
15.下列实验现象描述正确的是
A.当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路
B.钠在氧气中燃烧时火焰呈黄色,大冒白烟生成白色固体
C.铁丝在氯气中燃烧时冒出棕黄色的烟
D.钠放入水中,沉在杯底,在水底四处游动并产生气泡。
16.下列关于Na2CO3和NaHCO3的比较中,正确的是
A.在相同的较低温时, NaHCO3在水中的溶解度大于Na2CO3的溶解度
B.Na2CO3的热稳定性大于NaHCO3的热稳定性
C.同质量的两包固体,分别与足量的同浓度盐酸反应,NaHCO3放出CO2气体多, Na2CO3反应较剧烈且快
D.物质的量浓度相同时,NaHCO3溶液的pH大于Na2CO3溶液的pH,碱性较强些
17.下列物质的用途,不正确的是:
A.二氧化氯用于饮用水的消毒 B.镁用于制造信号弹烟花
C.钠和钾的合金用于快中子反应堆 D.溴化银用于人工降雨
18.NA表示为阿伏加德罗常数,下列说法正确的是
A.1mol黄豆中含有NA个黄豆粒
B.常温常压下,16gO2和16gO3所含氧原子数都是NA
C.标准状况下,11.2L的水中含有0.5NA个H2O分子
D.含1molHCl的盐酸溶液与足量Fe反应,整个反应中失(或得)的电子总数为2NA
19."NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl"是"侯氏制碱法"的重要反应原理。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
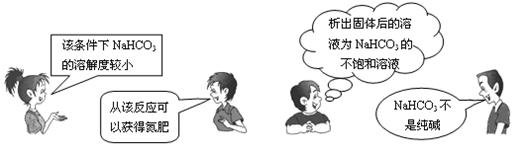
A B C D
20.为了确定某物质的变质情况,括号内所选的方法,不能达到实验要求的是:
A.Na2O2是否转变为Na2CO3(加盐酸看能否产生气体)
B.配制较长时间的氯水是否已经完全变质(加品红试液看能否使品红褪色)
C.KI晶体是否被氧化,有I2生成(加淀粉溶液看能否使其变蓝)
D.开封包装袋的漂白粉是否变质(加盐酸看是否有使石灰水变混浊的气体产生)
|
一、选择题(本题包括20小题,1~10每小题2分,11~20每小题3分,共50分。每小题只有一个正确答案)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| |||||
|
二、填空题(本题共3小题,共22分)
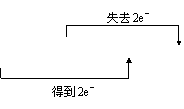
21.(8分)用长桥式标出下列反应中电子转移的方向和数目,并指出氧化剂和还原剂。
(1)Cl2 + H2O ![]() HClO + HCl
氧化剂
;
HClO + HCl
氧化剂
;
(2)MnO2 + 4HCl(浓) == MnCl2 + Cl2↑+ H2O 还原剂 。
22.(8分)洪涝灾害过后,饮用水的杀菌消毒,将成为抑制大规模传染性疾病爆发的重要的方法之一。漂白粉是常用的消毒剂。
(1)工业上将Cl2通入消石灰[Ca(OH)2]制取漂白粉,化学反应方程式为:
;
(2)漂白粉主要成分是(填化学式,下同) 有效成分是 ;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 ;
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) ;
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚酞溶液,溶液先呈红色,但随后溶液迅速褪色,说明漂白粉溶液呈 性,并具有 性。
23.(6分)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。
,
。
|
三、判断填空题(本题共2小题,共12分)
24.(6分)有以下几种物质①干燥的食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)⑥MgCl2溶液 填空回答(填序号):
(1)以上物质能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 ;
25.(6分)根据下列几种粒子的结构示意图,回答问题:(填编号)
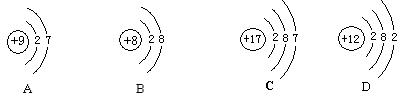
(1)其中属于阴离子的是 ,
(2)属于金属元素的是 ,
(3)具有相似化学性质的是 。
|
 四、实验题
四、实验题
(本题共2小题,共15分)
26.(6分)回答下列问题:
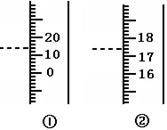
右图是温度计、量筒的一部分,其中 是温度计,
读数为 ℃;另一个是量筒,读数为 mL.
27.(9分)实验室配制500mL、0.2mol/L的CuSO4溶液,实验操作步骤有:
A.用天平称出25.0gCuSO4·5H2O晶体,放在烧杯中,用适量的蒸馏水使它溶解并恢复至室温。B.将制得的溶液通过玻棒引流,小心地移至容量瓶中。C.继续向容量瓶加蒸馏水,至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。D.用蒸馏水洗烧杯和玻棒2—3次,每次洗液都小心注入容量瓶,并轻轻振荡。E.将瓶塞塞紧,反复上下颠倒,摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,还缺少的仪器是 、 、 。
(3)下列情况会使所配溶液浓度偏高的是(填序号)
a.某同学观察液面的情况如图所示(视线偏高)
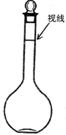 b.没有进行上述的操作步骤D
b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质(或者使用生锈的砝码)
e.将胆矾改成16.0g无水CuSO4配制
|
五、计算题(本题共2小题,21分)
28.(8分)已知Na3PO4是强电解质,在水溶液中电离成Na+和PO43-。
①请写出Na3PO4在水溶液中的电离方程式。
②若将164gNa3PO4的溶于水中配成2L溶液,则溶液中:
Na3PO4的物质的量浓度为多少?
Na+的物质的量浓度为多少?
29.(13分)把2.48克MgCl2和MgSO4的混合物溶于约45mL水中,滴加0.2 mol/LBaCl2溶液40 mL恰好沉淀完全。求原混合物中MgCl2和MgSO4的物质的量之比。
高一化学试卷参考答案
第Ⅰ卷 (选择题答题卡50分)
一、选择题(1~10每小题2分,11~20每小题3分,共50分,每小题只有一个正确答案)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | D | A | D | A | B | C | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | D | A | C | B | D | B | C | A |
第Ⅱ卷(非选择题70分)
二、填空题(本题共3小题,共22分)
![]() 21.(共8分)
21.(共8分)
(1)
 Cl2 +H2O
= HClO + HCl
(3分)
Cl2 +H2O
= HClO + HCl
(3分)
氧化剂:Cl2 (1分)
 (2)
(2)
![]() MnO2
+ 4HCl(浓) == MnCl2 + Cl2↑+ H2O (3分)
MnO2
+ 4HCl(浓) == MnCl2 + Cl2↑+ H2O (3分)
还原剂:HCl (1分)
22.(共8分)
(1)2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O(2分)
(2)Ca(ClO)2(1分)
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO(2分)
(4) (1) (1分)
(5)碱性(1分) 强氧化性(1分)
23. (共6分)
(1)纯碱;(2分) (2)H+ + OH- = H2O (2分);
H++ CO32- =CO2↑+ H2O (2分)
三、推断填空题(本题共2小题,共12分)
24.(共6分)
(1)3、6;(2分) (2)1、5;(2分) (3)2、4 ;(2分)
25.(共6分)
(1)B(2分)、 (2)D(2分)、 (3)AC(2分)
四、实验题(本题共2大题,共15分)
26.(共6分)
① (2分) 14 (2分) 17.4 (2分)
27.(共9分)
(1)ABDCE(2分)
(2)玻璃棒、胶头滴管、500 mL容量瓶(3分)
(3)a、d(4分)
五、计算题(本题共2大题,共21分)
28.(共8分)
①Na3PO4=3Na ++PO43-, (2分)
② 0.5 mol/L (3分)
1.5 mol/L (3分)
29:(共13分)
解: MgSO4+BaCl2=BaSO4↓+MgCl2 (1分)
n(MgSO4) = n(BaCl2) = 0.2mol/L×0.04L = 0.008mol (2分)
m(MgSO4) =0.008mol×120g/mol = 0.96g (2分)
m(MgCl2) = m(总) - m(MgSO4) = 2.48g - 0.96g = 1.52g (2分)
n(MgCl2) = m(MgCl2)/M(MgCl2) = 1.52g/(95g/mol) = 0.016mol (2分)
∴ n(MgCl2) : n(MgSO4) = 2 : 1 (2分)
答:原混合物中MgCl2和MgSO4的物质的量之比为2:1。 (2分)
(其它合理解法,参照给分)
【命题 张 军、钱先文】