高一化学物质及其变化单元测试题
班别___________ 学号____________ 姓名___________ 成绩____________
可能用到的相对原子质量: O 16 Cl 35.5 Mn 55
时间:40分钟
有些同学第一次测验的成绩不尽人意,你们可知道每个人并不是一开始就成功的,只有自信与坚持不懈的努力才会迎来一片光明。有些同学第一次测验已尝得成功的滋味,那就请你们从成功走向成功吧!
一、选择题(1-12题每小题只有一个正确选项,13、14题有一或二个正确选项,每小题4分,共56分)
1、下列分散系最稳定的是
A.悬浊液 B.乳浊液 C.胶体 D.溶液
2、NaHSO4在水溶液中能够电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是
A.NaHSO4是盐 B.NaHSO4是酸
C.NaHSO4是钠盐 D. NaHSO4是酸式盐
一(9)班 陈明明
纳米科技是21世纪经济发展的发动机。人们会利用纳米级(1-100nm,1nm=10-9m)微粒
物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。请解答3、4两题。
3、下列分散系与纳米级微粒在直径上具有相同数量级的是
A.溶液 B.胶体 C. 悬浊液 D.乳浊液
4、将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中不正确的是
A. 该分散系不能发生丁达尔现象 B.该分散质颗粒能透过滤纸
C. 该分散系属于胶体
D.该分散质颗粒能发生布朗运动
一(8)钟文标
5、下列反应既属于离子反应,又属于氧化还原反应的是
A.Zn与CuSO4 溶液的反应 B.分解氯酸钾制氧气
C.NaOH溶液与盐酸中和 D.MgCl2溶液 与KOH溶液产生沉淀
一(9)班 李哲
6、能用Ba2+ + SO42- = BaSO4↓表示的化学反应是
A.BaCO3 + H2SO4 = BaSO4↓+ H2O + CO2↑
B.Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O
C.Ba(NO3)2 + Na2SO4 = BaSO4↓+ 2NaNO3
D.Ba(OH)2 + CuSO4 = BaSO4↓+ Cu(OH)2↓
7、必须加入还原剂才能实现的反应是
A.KMnO4 → O2 B.Fe3+ → Fe2+ C.S → SO2 D.CO32- → CO2
8、在pH=1的无色溶液中,能够大量共存的离子组是
A.Cu2+、Cl-、Ba2+ 、Na+ B.K+、CO32-、Na+ 、Cl-
C.K+ 、Ba2+ 、OH-、NO3- D.Mg2+ 、Na+、Cl-、SO42-
一(6)班 阮立
9、下列物质属于电解质的是
①NaOH ②BaSO4 ③Cu ④蔗糖 ⑤SO2
A.①② B.①②⑤ C.③④ D.①⑤
10、下列有关说法正确的是
A.能在水溶液或熔融状态下导电的物质是电解质
B.电离出氢离子的化合物是酸
C.纳米材料也是一种胶体
D.丁达尔效应,是胶体粒子对光散射形成的
11、下列离子方程式与化学反应事实一致的是
A.石灰石溶于盐酸:CO32- + 2H+ == H2O +CO2↑
B.硫酸铜溶液与氢氧化钡溶液反应 :Cu2+ + 2OH- == Cu(OH)2↓
C.硫酸氢钠溶液与氢氧化钾溶液反应:H+ + OH- == H2O
D.硝酸银溶液与氯化钠溶液反应:AgNO3 + Cl- == AgCl↓+NO3—
12、有关氧化还原反应的叙述错误的是
A.复分解反应一定不是氧化还原反应 B.置换反应都是氧化还原反应
C.金属单质只能做还原剂 D.氧化还原反应的本质是化合价的升降
一(7)李志坚
13、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4 +2 H2O = NaBO2 + 4H2↑下列说法中正确的是(NaBH4中H元素为-1价)
A. NaBH4既是氧化剂以是还原剂 B. NaBH4是还原剂,H2O是氧化剂
C. 硼元素被氧化,氢元素被还原 D. 被氧化的元素与被还原的元素质量比为1:1
14、下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.O3+2KI+H2O=2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl+MnO2=MnCl2+Cl2↑+H2O
如果你是一个热爱生活的人,也是一个热爱学习的人,那就努力让你的学习与生活亲近起来吧!让我们在生活中学习化学,在化学学习中思考生活。
二、本题包括四小题,共32分
请你阅读下面两条科普信息,回答问题:
16、(4分)(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有 性,铁离子具有 性,(1)中的维生素C是 剂,(2)中的CO2 是 剂。
17、(8分) 双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN + H2O2 + H2O = KHCO3 + A↑(已配平)
(1)生成物A的化学式为
(2)反应中被氧化的元素为
(3)该反应中的氧化剂是
(4)若将KCN改为HCN也发生类似一述反应,则该反应的化学方程式为
。
18、(8分)离子反应在污水处理方面也有实际应用,例如:某河段两岸有甲、乙两家工厂,排出的废水中分别含有下列离子中的三种:K+、Ag+、Fe3+、OH-、Cl-、NO3- 等,经测定,甲厂的废水呈明显碱性,则甲厂废水含有的离子是 ,乙厂的废水含有的离子是 。为了消除两厂废水的污染,可控制两厂排出废水的流量使之混合,将大部分污染性强的离子沉淀而除去,用离子方程式表示这种治污原理
。
19、(12分)现有下列8种物质,请按要求回答问题:
①淀粉溶胶 ②锌 ③氧化铁 ④碳 ⑤盐酸 ⑥苛性钠 ⑦碳酸钙
⑧氢氧化铜悬浊液
⑴ 运用树状分类法将这些物质(用化学式表示)进行分类。(要求分至最基本的类型,参看下图例示,将上述物质分类写在下图中)
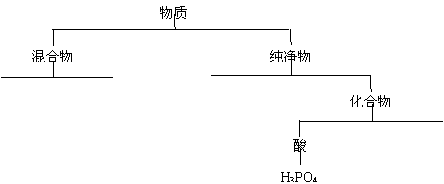 |
⑵ 常温下,上述物质两两混合,能够制取的气体有___________________,所发生的反应属离子反应的写出离子方程式,并注明反应类型(按反应形式分)__________________________________________________________________________________________ 。
三、本题包括1小题,共8分
20.(8分)已知: MnO2 +4HCl(浓) △ === MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:
⑴反应耗用MnO2的质量 ⑵被氧化的HCl物质的量 (3)原浓盐酸的物质的量浓度
试题答卷
班别___________ 学号____________ 姓名___________ 成绩____________
一、选择题(1-12题每小题只有一个正确选项,13、14题有一或二个正确选项, 每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
二、本题包括四小题,共32分
16、(4分) , ,
, 。
17、(8分)(1)
(2)
(3)
(4)
18、(8分)(1) ,
19、(12分) (1)
(1)
(2) ,
三、本题包括1小题,共8分
20.(12分)(1)
(2)
(3)
答案
一、选择题(每小题只有一个正确选项,每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | B | B | A | A | C | B | D | A | D | C | D | BD | AD |
二、本题包括四小题,共32分
16.(4分)还原性;氧化性;还原;氧化。 (每空1分)
17.(8分)(1)NH3 (2)-1价的氧元素 (3)H2O2
(4)HCN + H2O2 = CO2↑ + NH3↑(各2分,共8分)
.18.(8分)(8分)OH-、Cl-、K+(2分),Ag+、Fe3+、NO3-(2分),
Ag+ + Cl- = AgCl↓(2分),Fe3+ + 3OH- = Fe(OH)3↓(2分)
19.(12分)(12分)
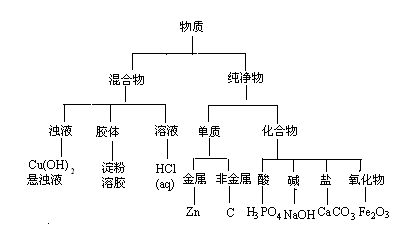 |
⑴ (4分)
⑵ H2和CO2(2分)
Zn + 2H+ = Zn2+ + H2↑置换反应,(3分)
CaCO3 +2H+ == Ca2+ +CO2↑+ H2O 复分解反应(3分)
20.(12分)(9分)(1)17.4g(3分),(2)0.4 mol(2分),(3)9 mol/L(4分)