高一化学卤素单元检测题
考试时间:100分钟 总分:110分
第Ⅰ卷 选择题(共54 分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Br-80 Mn-55 Na-23
一、选择题(每小题只有一个选项符合题意,每小题 3分共54 分)
1.下列物质属于纯净物的是:
A.液氯 B.氯水 C.漂白粉 D.碘酒
2.有关卤素的说法正确的是:
A.卤素是典型的非金属元素,其单质只具有氧化性而无还原性
B.卤素单质的熔点随相对分子质量的增大而升高
C.卤化银都不溶于水,也不溶于稀硝酸
D.卤化氢的水溶液都是强酸
3.检验氯化氢气体中是否混有Cl2,可采用的方法是:
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
4.若NA表示阿伏加德罗常数的值,下列说法正确的是:
A.在标准状况下,NA个水分子所占的体积约为22.4L
B.5.6g铁与氯气完全反应,失去电子的数目为0.2NA
C.1mol氯气发生化学反应,转移的电子数必为2NA
D.CH4的摩尔质量与NA个CH4分子的质量在数值上相等
5.下列关于氯水的叙述,不正确的是:
A.新制的氯水呈浅黄绿色是因为含有Cl2分子
B.新制的氯水可使蓝色的石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性将增强
6.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;
Cl2→Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到碘最多的是:
A. Fe3+ B. MnO4- C. Cl2 D.HNO2
7.下列离子方程式正确的是:
A.碘化钾溶液跟适量溴水反应:I-+ Br2 = Br-+ I2
B.氯气与水的反应:Cl2+ H2O = Cl- + ClO- + 2H+
C.二氧化锰与浓盐酸反应:MnO2 + 4H+ +2Cl-= Mn2+ + Cl2↑+ 2H2O
D.Cl2与氢氧化钠溶液的反应:Cl2+ 2 OH-= Cl-+ ClO-+ H2O
8.下列物质的用途与其性质的对应关系错误的是:
A.氯气用于自来水消毒— 次氯酸的强氧化性 B.溴化银用于照相术— 光照分解
C.氢氟酸腐蚀玻璃— 强酸性 D.碘化银用于人工降雨— 使空气中水蒸汽凝聚
9.下列无色透明溶液,能大量共存的是:
A.K+、Na+、Cl—、HSO3—、OH— B .Cl—、NO3—、MnO4—、K+、Na+
C.SO42—、K+、Mg2+、Cl—、NO3— D.H+、Cl—、Br—、HS—、K+
10.将0.15 mol的MnO2和过量的12 mol/L的浓盐酸反应,与50 mL12 mol/L的浓盐酸和过
量MnO2反应,两者产生的氯气相比(其它反应条件相同):
A.一样多 B.前者比后者多 C.后者比前者多 D.无法比较
11.在NaCl、MgCl2、MgSO4三种盐配制的混合液中,c(Na+)=0.1 mol/L, c(Mg2+)=0.25 mol/L,
c(Cl— )=0.2 mol/L,则c(SO42 -)为 :
A. 0.5 mol/L B. 0.15 mol/L C.0.25 mol/L D.0.2 mol/L
12.同温同压下,下列溶液中吸收氯气的量比同体积的水吸收氯气的量更多的是:
A. HCl B. NaCl C. H2SO4 D.Na2SO3
13.除去食盐中少量的Ca2+和SO42—,而又不引入新的杂质离子,应依次加入:
A.BaCl2、Na2CO3 B.Na2CO3、BaCl2
C.Ba(NO3)2、Na2CO3、HCl D.BaCl2、Na2CO3、HCl
14.在3Cl2 + 8NH3 = 6NH4Cl + N2反应中,如有6.8g氨被氧化,则被还原的氯气是:
A.106.5g B.10.65g C.42.6g D.8.52g
15.18世纪70年代,瑞典化学家舍勒在研究一种白色的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑,并有刺激性气味,此盐是:
A.AgF B.AgCl C.AgBr D.AgI
16.有一种碘和氧的化合物可以称作为碘酸碘,其中碘元素的化合价呈+3、+5两种价态,则这种化合物的化学式为:
A.I2O4 B.I3O5 C.I4O7 D.I4O9
17.氯气与碘在加热的条件下以一定比例反应可得的一红棕色液体ICl(氯化碘),ICl的性质类似于卤素,有很强的化学活动性。例如:ICl + H2O = HCl + HIO,2 Zn + 2 ICl = ZnCl2 + ZnI2 ,下列叙述正确的是:
A.在H2O跟ICl的反应中, ICl既是氧化剂又是还原剂
B.在H2O跟ICl的反应中, ICl是氧化剂H2O是还原剂
C.在Zn跟ICl的反应中,ZnCl2既是氧化产物又是还原产物
D.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物
18.标准状况下的H2、Cl2混合气体a升,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为:
A.b=![]() B.b<
B.b<![]() C.b>
C.b>![]() D.b≥
D.b≥![]()
 一、选择题(3×18=54分)
一、选择题(3×18=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷 非选择题(共56分)
二、填空题(本题5小题,共30分)
19.(4分) 氯水中含有多种成分.将紫色石蕊试液滴入石蕊中,溶液显红色,起作用的成分主要是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分是 。往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是 。氯水能使淀粉碘化钾试纸变蓝,起作用的成分是 。(以上空白均填化学式)
20.(4分) KClO3和浓盐酸在一定条件反应会生成绿黄色的易爆物二氧化氯,化学反应方程式如下:2KClO3 + 4HCl = 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
⑴浓盐酸在反应中显示出来的性质是 ;
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
⑵产生0.1 mol Cl2 ,则转移的电子总数约为______________________
21.(12分)某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列5步实验,观察到的现象记录如下:
⑴混合物加水得到无色透明溶液
⑵向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将沉淀滤出,并将滤液分成两份
⑶上述白色沉淀可完全溶于稀盐酸
⑷往一份滤液中滴加氯水并加入CCl4,振荡静置,CCl4层无色
⑸往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸
由此可推断出:混合物中一定含有 ;无法确定是否含有的是:
;为了进一步确定该混合物的组成,最简单的方法是
_________________________________; 请写出有关反应的离子方程式:
____________________________________________________________________________
22.(4分)法医做指纹实验时,常用AgNO3溶液喷洒指纹,经过处理后会出现黑色的纹路,请用化学方程式表示其原理是:
① 。② 。
23.(6分)在3BrF3+5H2O = HBrO3+Br2+9HF+O2的反应中,每3 mol的BrF3中被水还原的BrF3的物质的量是_____________,氧化产物与还原产物物质的量之比为____________
三、实验题(本题共18分).
24.下图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题:
⑴(4分)小试管的作用是 ;烧瓶中发生反应的离子方程式是 ;
⑵(4分) B瓶中的溶液最好是 ,其作用是 ;
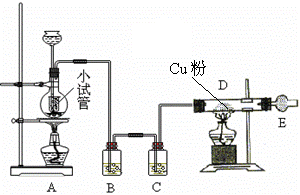 C瓶中的溶液是
,其作用是
。
C瓶中的溶液是
,其作用是
。
⑶(4分)玻璃管D中发生反应的化学方程式为 ,现象是 。
⑷(2分)干燥管E中盛有碱石灰,其作用是 。
⑸(4分)开始实验时,应先点燃 处(填“A”或“D” )的酒精灯,当_____________________
时再点燃另一处的酒精灯。
四、计算题(共8分)
25.(8分)取软锰矿17.4g(主要成分为MnO2,其杂质不与浓盐酸反应)与足量的浓盐酸反应后,将生成的Cl2通入到200mL NaBr溶液中(其中含22g NaBr),经加热蒸发水分并烘干后,得到质量为13.1g的残渣。试计算:
(1)通入Cl2后,溶液中NaCl的物质的量浓度(忽略溶液的体积变化)
(2)软锰矿中MnO2的质量分数
 一、选择题(3×18=54分)
一、选择题(3×18=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | D | D | C | B | D | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | D | D | D | C | B | D | D | D |
19、HCl ;HClO ; HCl ; Cl2
20、(1)②(2)1.204×1023
21、Na2CO3 ; NaCl、KNO3 ; 焰色反应和硝酸酸化的硝酸银溶液
|
22、AgNO3 + NaCl = AgCl ↓+ NaNO3 ;2AgNO3 = 2Ag + Cl2↑
23、4/3 mol ;2:1
![]() 24、(1)液封(防止Cl2从长颈漏斗中逸出) MnO2 + 4H+ + 2Cl- = Mn2+ +
Cl2↑ + 2H2O
24、(1)液封(防止Cl2从长颈漏斗中逸出) MnO2 + 4H+ + 2Cl- = Mn2+ +
Cl2↑ + 2H2O
(2)饱和食盐水;除去Cl2中的HCl ;浓H2SO4 ;干燥Cl2
(3)Cu + Cl2 = CuCl2 ;产生棕黄色的烟
(4)吸收未反应完的Cl2
(5)A ;D中充满黄绿色的气体后
25、⑴.1mol/L ⑵.8.7g ; 50%