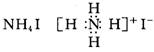高一化学四月期中考试试题
注意: 1. 本试卷分第Ⅰ卷和第Ⅱ卷两部分。全卷共4页,满分为100分。考试时间90分钟。
2.可能用到的相对原子量:H-1 Cu-64 O-16 Na-23 Ca-40 S-32 N-14 第Ⅰ卷(共54分)
一、选择题(每小题只有1个选项符合题意,每小题3分) .
1.某气体在靠近地面的空气中若浓度稍大是一种污染物,而在高空形成的气层却对地球生物有保护作用,该气体是下列的 ( )
A.NO B.O3 C.CO D.CO2
2.下列物质的电子式书写正确的是 ( )
A ![]() B.
B. ![]()
|
C.![]() D. D.
D. D.
3. 关于原子结构的叙述正确的是 ( )
A. 所有的原子核都是由质子和中子组成的
B. 原子的最外层电子数不超过8个
C. 稀有气体原子的最外层电子数均为8
D. 原子的次外层电子数一定都是8
4. 常温下能用铁罐或铝罐贮存的是 ( )
A.浓H2SO4 B.浓HCl C.稀H2SO4 D.稀HCl
5. 密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶
质质量分数( )
A.小于12.5% B.大于12.5% C. 等于12.5% D.不能确定
6.![]() 可以作为核聚变材料,下列关于
可以作为核聚变材料,下列关于![]() 的叙述正确的是 ( )
的叙述正确的是 ( )
A.![]() 和 13H互为同位素
和 13H互为同位素
B.![]() 原子核内中子数为2
原子核内中子数为2
C.![]() 原子核外电子数为2
原子核外电子数为2
D.![]() 代表原子核内有2个质子和3个中子的氦原子
代表原子核内有2个质子和3个中子的氦原子
7 . 下列说法正确的是 ( )
A.SiO2晶体易溶于水,水溶液呈现酸性。
B.CO2通入水玻璃中可以得到硅酸。
C.SiO2是酸性氧化物,它不溶于任何酸。
D.高温时SiO2可和Na2CO3反应放出CO2,这可以说明硅酸的酸性比碳酸的酸性强。
8. 下列反应中,SO2不是作为还原剂而发生的氧化还原反应的是 ( )
![]()
![]()
|
C.SO2+2H2S====3S↓+2H2O D.SO2+Cl2+2H2O====H2SO4+2HCl
9. 设NA为阿佛加德罗常数,下列叙述中正确的是 ( )
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C. 3.9gNa2O2吸收足量的CO2时转移的电子数是0.1NA
D. 由2H和18O所组成的水11g,其中所含的中子数为5NA
10.对于某些离子的检验及结论一定正确的是 ( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
11. 下列说法不正确的是 ( )
A.铵盐都属于离子化合物
B.镁条在空气中燃烧的产物主要是MgO
C.白磷与红磷之间的相互转化属于氧化还原反应
D.磷酸和偏磷酸的酸酐均为P2O5
12.下列各组物质的性质及粒子变化正确的是 ( )
A. 酸性:HClO4>H2SO4>H3PO4>H2CO3
B. 稳定性:H2S>HCl>HBr>HI
C. 粒子半径:Br—>K + >S2— >S
D. 还原性:Na>S2— >Cl—>Br— >I-
13.短周期元素X、Y的原子序数相差2,下列有关叙述正确的是 ( )
A. X与Y不可能位于同一主族 B. X与Y一定位于同一周期
C. X与Y不可能形成共价化合物XY D. X与Y可能形成离子化合物XY
14.下列反应的离子方程式正确的是: ( )
A. 将SO2通入Ca(ClO)2溶液中:
SO2 + H2O + Ca2+ + 2ClO- = CaSO3↓+ 2HClO
B. 氯气溶于水:Cl2 + H2O = 2H+ + Cl- + ClO—
C. 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+
+ OH-+ H+ + SO![]() = BaSO4↓+H2O
= BaSO4↓+H2O
D.用NaOH溶液吸收尾气Cl2: Cl2 + 2OH—= Cl—+ClO—+H2O
15.下列变化的实质相似的是: ( )
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D.HBr,HI气体不能用浓H2SO4制取
16. 下列指定微粒的个数比为2:1的是 ( )
A.Be2+离子中的质子和电子
B.21H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
17. 向BaCl2溶液中通入SO2没有沉淀生成。但若先加入一种试剂,再通入SO2,则可看到沉淀生成,这种试剂可能是:①NH3 ②NaOH ③HCl ④CO2 ⑤Cl2。 ( )
A.①②④ B.②③ C.④⑤ D.①②⑤
18. 向25mL18.4mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量是 ( )
A.小于0.23mol B.等于0.23mol C.0.23mol~0.46mol之间 D.等于0.46mol
第Ⅱ卷(共46分)
二、填空题
19.(4分)有以下几种物质,按要求填写物质代号:
A.金刚石 B.D2O C.126C D.C60 E.Na2O2 F.H2O
G.CO2 H.146C I.NaOH J.147N
(1) 属于同素异形体的是____________
(2)互为同位素的是______________
(3)含有极性键的离子化合物的是_____________
(4)既含有非极性共价键又含有离子键的是____________
20.(12分)下面是元素周期表的一部分,针对①—⑩元素填写下列空白
| 主族 周期 | IA | O | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
(1)在这些元素中,属于金属元素的有________________(填元素符号)
(2)画出⑦元素原子结构示意图______________________________
(3)写出①和⑩形成的化合物的电子式_______________________
(4)用电子式表示④和⑥形成化合物的过程 。
(5)写出①和②的最低价形成气态分子的化学式______________,
判断分子为 。(填极性分子或非极性分子)
(6)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
三、推断题
21.(10分)从某物质A的水溶液出发有如图所示的转化关系,
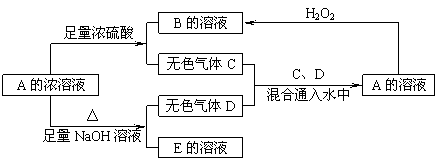 |
其中A为正盐,气体C能使品红溶液褪色,气体D能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)写出A的化学式: _________,D的结构式____________。
(2)写出下列反应的离子方程式
①A与足量NaOH溶液(加热)_____________________ _。
②C、D通人水中:_____________ 。
(3)检验B溶液中阴离子的实验操作和实验现象是___________________________________ 。
四、实验题
22.(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_____(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某学生进行了如下设计:
先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_______(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
(4)如果(3)中测得标准状况下产生SO2的体积为1.792L,则被还原的硫酸的物质的量为 mol。
五、计算题
23.在一定条件下,NO和NH3可以发生如下反应6NO+4NH3=5N2+6H2O,现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
求: 若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
答案
1. B 2. C 3 . B 4. A 5. A 6. C 7. B 8. C 9. A 10. C 11.C 12. A 13. D 14. D 15. D 16. A 17.D 18.A
19(1)AD (2)CH (3)I (4)E
20 (1)⑤④⑨
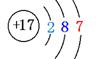
(2)
(5)CH4 非极性分子
(6)IVA族
21 (1)(NH4)2SO3
(2)①NH4++ +OH-= +NH3↑+H2O
②NH3+SO2+H2O=2NH4++SO32-
(3)取少量B溶液于试管中,加入稀盐酸,无沉淀,再加入BaCl2溶液,出现白色沉淀,证明含有SO42-
22(1)B装置中导气管长进短出(2分)
(2)①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O (2分);
CuSO4 + SO2↑+ 2H2O (2分);
②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应(2分);
③A、D(2分)
(3)①A、B、C(2分)
(4)0.08
23 略