高一化学下学期期中试题
高一化学
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
试题总分值:100分 考试时间:100分钟
可能用到的原子量:H 1 C 12 O 16 Cl 35.5 Ag 108 N 14
第Ⅰ卷 (选择题 共46分)
注意事项:
1.使用答题卡作答的,答第一卷前,考生务必将自己的姓名、考试证号、考试科目用铅笔涂写在答题卡上。第一卷答案必须填涂在答题卡上,在其它位置作答无效。每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。
2.答卷前请将密封线内的项目填写清楚。
一、选择题(本题包括8小题,每小题2分,共16分,每小题只有一个选项符合题意)
1.元素的化学性质主要决定于原子的 ( )
A. 质子数 B.中子数 C.核外电子数 D.最外层电子数
2.下列说法错误的是: ( )
A.含有共价键的化合物一定是共价化合物 B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物 D.离子化合物中可能含有共价键
3.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O与NH4Cl
的反应要吸收热量,在化学上叫做吸热反应。其原因是 ( )
A.在化学反应中需要加热的反应就是吸热反应
B.在化学反应中需要降温的反应就是放热反应
C.反应物所具有的总能量低于生成物所具有的总能量
![]() D.反应物所具有的总能量高于生成物所具有的总能量
D.反应物所具有的总能量高于生成物所具有的总能量
4.镍—镉可逆电池的反应式为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,其
电极的正极材料是 ( )
A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2
5.对于反应A+B=C,下列条件的改变一定使化学反应加快的是 ( )
A.增加A的物质的量 B.升高体系的温度
C.减少C的物质的量 D.增加体系的压强
6.关于放热反应A+B → C+D,以下说法正确的是(EA、EB、EC、ED分别代表A、B、C、
D所具有的能量)( )
A. EA>EB B. EA>EC+ED C. EA+EB>EC+ED D. EA+EB<EC+ED
7.一定条件下,在体积为VL的密闭容器中,发生反应mA+nB=pC,t秒末,A减少了1.0mol,B减少了1.25mol,C增加了0.5mol,则m:n:P为 ( )
A.2:5:4 B.4:5:2 C.1:3:2 D.1:4:5
8.某一反应物的浓度是2mol· L-1,经过4min后,它的浓度变成1.68 mol· L-1,则在这4min内它的平均反应速率为 ( )
A. 0.2 mol·L-1·min-1 B. 0.1 mol·L-1·min-1
C. 0.04 mol·L-1·min-1 D. 0.08 mol·L-1·min-1
二、选择题(本题包括10小题,每小题3分,共30分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个该小题就为0分。)
9.日常所用干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质,电极反
应可简化为Zn – 2e- =Zn2+ ,2NH4++2e- =2NH3+H2(NH3再用于结合Zn2+)。根据上述叙述判断下列说法中正确的是 ( )
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电子由Zn经外电流路向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D.干电池可以实现化学能向电能的转化和电能向化学能的转化
10.离子键的强弱主要决定于离子半径和离子电荷值。一般规律是:离子半径越小,电荷
值越大,则离子键越强。试分析:①K2O ②CaO ③MgO 的离子键由强到弱的顺序是 ( )
A.①②③ B.③①② C.②①③ D.③②①
11.下列说法中,正确的是 ( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
12.下列分子中所有原子都满足最外层为8个电子结构的是 ( )
A.BF3 B.SiCl4 C.H2O D.PCl5
13. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
| X | Y | |
| Z | W |
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔、沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
14.某课外小组做了一个有趣的实验,将2g铝粉和3g碘粉小心混合均匀,分成相等三份,分别进行实验,现将实验记录列表如下:
| 第一组 | 加入0.5g水 | 很快产生火花 |
| 第二组 | 加入1g胆矾 | 约30s产生火花 |
| 第三组 | 加入1g无水硫酸铜 | 1min内没有明显现象 |
根据上述实验事实,作出的推断错误的是 ( )
A.水能加快铝和碘的反应 B.第一组实验中铝和碘发生反应生成了AlI3
C.第一组和第二组实验中均放出热量 D.第三组铝和硫酸铜发生了置换反应
15.下列关于化学反应速率说法正确的是 ( )
A.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.根据化学反应速率的大小可以知道化学反应进行的快慢
C.化学反应速率为0.8mol·L-1·S-1, 是指1s时,物质的量浓度为0.8mol·L-1
D.对任何化学反应来说,反应速率越大化学现象越明显
16.短周期的三种元素X、Y、Z,已知X元素的原子最外层只有一个电子,Y元素的原子M层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2个,则这三种元素所组成的化合物的化学式不可能的是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
17.两种微粒的质子数和电子数均分别相等,它们不可能是 ( )
A.一种阳离子和一种阴离子 B.一种单质和一种化合物分子
C.一种分子和一种离子 D.一种原子和一种分子
18.短周期元素A、B、C, 原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是 ( )
A.元素的金属性A<B<C B.A的氢化物的稳定性大于C的氢化物
C.B的最高价氧化物的对应水化物呈碱性D.A与C可形成离子化合物
第Ⅱ卷 (非选择题 共54分)
三、实验题(本题包括2个小题,共22分)
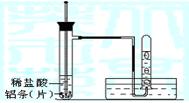
19.(10分)某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、胶头滴管、温度计;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置 (图中铁架台等夹持仪器略去)
|
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性,具体操作方法是:
。
②取3块铝条加入到试管中,操作方法是
。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
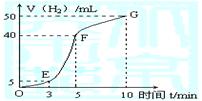
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
|
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG表示),并解释原因
速率大小比较: 。原因:____________________________
20.(12分)动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
① ,② ,
(4)实验结论: ,
四、(本题包括3个小题,共24分)
21.(5分)有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
![]() (1)A+B
(1)A+B![]() C+D↑ (2)C+ C A+E
(3)D+E
C+D↑ (2)C+ C A+E
(3)D+E![]() B+C
B+C
由此可知它们的化学式分别为:
A ,B ,
C ,D ,
E 。
 22.(6分)A、B、C、D四种短周期元素,原子序数
22.(6分)A、B、C、D四种短周期元素,原子序数
D>A>B>C,且A、B同周期,C、D同主族,A的
原子结构示意图如右上图,B、C可形成离子化合物B3C2,
据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为
(3)B和C最高价氧化物的水化物化学式分别为 和 。
23.(13分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______________,碱性最强的化合物的电子式是:____________________________________;
(3) 用电子式表示元素⑦的单质分子的形成过程:________________________________
;
(4) 用电子式表示元素④与⑥的化合物的形成过程:_____________________________
,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物含的共价键类型是
(6)由③和④按原子个数比1:1形成的化合物的电子式是 该化合物含的化学键类型是
五、计算题(本题共8分)
24. (8分)某元素的同位素x zX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
高一化学参考答案及评分标准
1.D 2.A 3.C 4.B 5.B 6.C 7.B 8.D 9.BC 10.D
11.B 12.B 13.CD 14.D 15.B 16.A 17.AC 18.BC
19.(1)2Al+6HCl=2AlCl3+3H2↑(2分)
(4)①将导气管口放入水槽的水中,用手握住具支试管一会儿,如果导气管中有气
泡冒出,移开手后,导气管中有一段水柱上升,且水柱在较长时间内不回落,即证明该装置气密性良好。(2分)
②用镊子取铝条(片)放置在倾斜的试管口内,然后将试管缓缓直立起来,使铝条(片)滑落到试管底部。(2分)
(5)5mL; 35mL;10mL。EF>FG>OE。该反应是放热反应,随着温度的升高,反应速率增大,一段时间后,随着反应物的浓度的减小,反应速率减小。
20.(1) (1分)同周期 (2) 试管、烧杯、酒精灯(1分)
(3) (2分)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象 | B | F | A | C | D | E |
①(2分)Mg+2H2O![]() 2Mg(OH)2+H2↑ ②(2分)Na2S+Cl2 =2NaCl+S↓
2Mg(OH)2+H2↑ ②(2分)Na2S+Cl2 =2NaCl+S↓
(4)实验结论:(1分)金属性:Na>Mg>Al, (1分)非金属性Cl>S
21、OH-、NH4+ H2O NH3 H3O+ (每空1分,共5分)
22、硅, SiH4 N P Si Mg Mg(OH)2 HNO3 (第三空2分,其余每空1分,共6分)
![]() 23、⑴Ar (1分)⑵HClO4、KOH电子式略、 (2分)
23、⑴Ar (1分)⑵HClO4、KOH电子式略、 (2分)
⑶Cl2的分子形成 (2分)
⑷Na2S的形成过程 (2分)

⑸四氯化碳的电子式: 极性共价键(3分)
![]()
(6)电子式 离子键和非极性键(3分)
24. (1) XCl2 + 2AgNO3=2AgCl↓ + X(NO3)2
(A+71)g 2mol
1.11g 1moL/L×0.02L (1分)
解得A=40Z=20 (2分)
(2)第四周期,ⅡA族 (2分)
(3)有气泡产生 (1分) Ca+2H2O==== Ca(OH)2+H2↑(2分)