高一化学下学期期末模拟试卷1
一、选择题(每题只有一个选项符合题意)
![]() 1.从某微粒的原子结构示意图反映出
1.从某微粒的原子结构示意图反映出
A.质子数和中子数
B.中子数和电子数
C.核电荷数和核外电子层排布的电子数 D.质量数和核外电子层排布的电子数
2.下列各微粒中:①12Mg2+ ② ③![]() ④O2—,核外电子总数相同的是
④O2—,核外电子总数相同的是
A.②③④ B.①②④ C.①②③ D.①③④
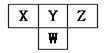 3.下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
3.下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
A.原子半径的大小顺序是W>Y>Z
B.X的氢化物没有Z的氢化物稳定
C.常见的X的氢化物具有正四面体结构
D.Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键
![]() 4.下列各项中表达正确的是
4.下列各项中表达正确的是
![]()
 A.NH3分子的电子式:
B.CH4分子的比例模型
A.NH3分子的电子式:
B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
5.下列各化学式中,所有原子(或离子)都满足最外层为8电子结构的化合物是
A.D2O B.NH3 C.Cl2 D.NaCl
6.下列物质性质递变正确的是
A.HBr、HCl、HF熔沸点由高到低 B.H2O、H2S、HCl热稳定性逐渐增大
C.KOH、NaOH、Al(OH)3碱性逐渐减弱 D.Si、Cl、P元素单质的氧化性逐渐增强
 |
7.C60分子结构 与足球 形状相似,它与金刚石 互为
A.同位素 B.同分异构体 C.同素异形体 D.同种物质
8.关于物质结构的下列各种叙述,正确的是
A.含有共价键的晶体,一定是原子晶体
B.离子晶体中,一定存在金属元素和非金属元素;
C.同时含有离子键和共价键的化合物,既可能是离子化合物,也可能是共价化合物
D.在共价化合物中一定存在共价键,但含有共价键的不一定是共价化合物
9.砹(At)是原子序数最大的ⅦA元素,试根据同族元素性质的相似性和递变性分析,下列各个推论,其中错误的是
A.HAt很稳定
B.AgAt既不溶于水也不溶于硝酸
C.砹单质易溶于有机溶剂 D.砹单质在常温、常压下是固体
10.2006年9月4日,国际在线报道:欧洲第一个月球探测器“智能一号”成功撞击月球。“智能一号”(SMART-1)是首枚采用太阳能离子发动机作为主要推进系统的欧洲探测器。它离开地球到达观测轨道一共只消耗了75kg的惰性气体燃料---氙。下列说法正确的是
A. 氙气燃烧过程中说明惰性气体能在氧气中燃烧
B. 在标准状况下,11.2L氙气含氙原子数约为6.02×1023
C. 氙比氩更容易和氟气反应
D.氙与氦属于同系物
11.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.电解水
B.干冰受热直接变成气体
C.HCl溶解于水
D.打雷放电时,O2变成O3
12.2006年3月5日,温家宝在十届全国人大四次会议上所作的《政府工作报告》中指出“抓好资源节约,建设环境友好型社会”这是我国社会及经济长期发展的重要保证。你认为下列行为中有悖于这一保证的是
A.大力发展农村沼气,使废弃的秸秆等转化为清洁高效的能源
B.减少汽车污染,开发环保型的如以天然气、甲醇、氢气或者以汽油和酒精混合为燃料的“绿色汽车”
C.解决能源危机,主要方法是提高轻质燃料油的产量
D.使用新工艺和新技术使燃料油充分燃烧,提高其利用率,节约燃料油
13.下列反应中生成物的总能量大于反应物总能量的是
A.H2在O2中燃烧 B.铁丝在氧气中燃烧
C.硫在氧气中燃烧 D.焦炭在高温下与水蒸气反应
14.反应4NH3(气)+5O2(气)= 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010mol/(L·s) B.v(O2)=0.0010mol/(L·s)
C.v(NO)=0.0010mol/(L·s) D.v(H2O)=0.0045mol/(L·s)
15.一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g) ![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.②③ C.③④ D.①④
16.下列关于乙烯和乙烷的说法中错误的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能
C.乙烯比乙烷稳定
D.乙烯分子中所有原子均在同一平面上,乙烷分子所有原子不在一个平面上
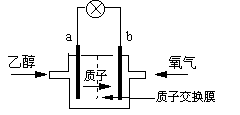 17.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
17.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2→2CO2 +3H2O,电池示意如右下图,下列说法不正确的是
A.a极为电池的负极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池工作时,1mol乙醇被氧化时就有12mol电子转移
D.电池正极的电极反应为:4H+ +O2+4e-=2H2O
18.下列家庭实验中不涉及化学变化的是
A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制甜酒酿 D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
19.由A、B两种烃组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的最简式;④烃中碳的质量分数相同。正确结论是:
A.①②③④ B.①③④ C.②③④ D.③④
20.1995年美国教授lagow报导,他制得碳的第四种同素异形体——链式炔碳……—C≡C—C≡C—C≡C—……。该物质一个分子中含300—500个碳原子,性质很活泼,据此判断,链式炔碳的熔点,估计比石墨
A.低 B.相等 C.高 D.无法判断
21.下列叙述不正确的是
A.植物油可作溴水中提取溴的萃取剂
B.油脂是热能最高的营养物质
C.淀粉、纤维素、蛋白质都是天然高分子化合物
D.生活中,鉴别羊毛和棉线的简易方法是在火中灼烧,根据发出的气味判断
22.现代以石油化工为基础的三大合成材料是:①合成氨 ②塑料 ③合成盐酸 ④合成橡胶 ⑤合成尿素 ⑥合成纤维 ⑦合成洗涤剂
A.②④⑥ B.②④⑦ C.①③⑤ D.④⑤⑥
23.狂犬病病毒为弹状病毒科狂犬病毒属中血清/基因1型病毒,其基因编码为N、M1、M2、G、L蛋白的5个基因,以下杀死狂犬病毒的方法不正确的是
A.加热 B.紫外线 C.强碱浸泡 D.NaCl溶液浸泡
二、填空题
24.A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2
,DCA_________________;
(2)用“化学式”和“<或>”比较:
A与C、A与F形成化合物的稳定性
;沸点的高低
,
沸点高低的原因
;
(3)写出E与烧碱反应的离子方程式
。
(4)用A元素的单质与C元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在a极通入A的单质,b极通入C的单质,a极的电极反应式是
;b极的电极反应式是
。若改为H2SO4作电解质溶液,则a极的电极反应式是 ;b极的电极反应式是
25.某有机物A由C、H、O三种元素组成。已知B是石油化工发展水平的标志,在一定条件下由B可以转变为有机物A、C、D、E、F。转变关系如下:

(1)写出A、B、E、F的结构简式:
A B E F
(2)写出实现下列转化的化学方程式,并注明反应类型
D转变为E________________________________________________、______________
B转变为C________________________________________________、______________
26.根据下列变化关系,请回答下
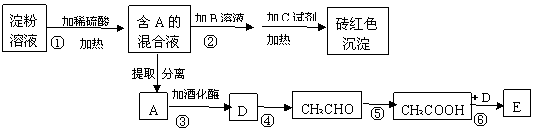
(1)写出A物质的名称_________。加B溶液的作用为_____________________________。
(2)写出④、⑥两步反应的化学方程式,并在( )号中标明反应类型。
④ ___________________________________________________( );
⑥ ___________________________________________________( )。
三、实验题
27.为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、
图二所示的实验。
(1)写出H2O2在催化条件下分解的化学反应方程式: 。
(2)图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
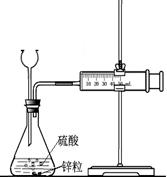
 |
图一 图二
指出图二装置中一处明显的错误 。
图二所示实验中需测量的数据是 。
四、计算题
28.向8g二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗硫酸体积为100mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定该金属氧化物为 ;
(2)该电解过程中的总反应方程式为 ;
(3)计算通电后硫酸溶液的物质的量浓度为(溶液体积按100mL计算) 。
29.标准状况下1.68L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1) 计算燃烧产物中水的质量。
(2) 若原气体是单一气体,通过计算推断它的分子式。
(3) 若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写一组)