高一级化学科第一学期中段考试
注意事项:
1、本试卷分为第I卷和第II卷两部分。考试时间100分钟,总分100分。
2、答卷前,考生务必用黑色字迹的钢笔或签字笔填在答题卡上将自己的班级、姓名、座号填上。用黑色字迹的钢笔或签字笔在答题卡上作答,答案必须写在指定区域内相应位置上,否则无效作废。
3、可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32
Cl—35.5 Ba—137
第I卷 选择题(共60分)
一、选择题(本题30小题,每小题2分,共60分。每小题只有一个选项符合题意)
1.在0.5mol Na2SO4中,含有的Na+数约是
A.3.01×1023 B.6.02×1023 C.0.5 D.1
2、下列溶液中含Cl-浓度最大的是
A、10mL0.1mol/L的AlCl3溶液 B、20mL0.1mol/LCaCl2溶液
C、30mL0.2mol/L的KCl溶液 D、100mL0.25mol/L的NaCl溶液
3、下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是
A.化合反应一定是氧化还原反应 B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应 D.复分解反应不一定是氧化还原反应
4、鉴别硫酸铜溶液与氢氧化铁胶体最简便的方法是
A.萃取 B.蒸馏 C.过滤 D.丁达尔效应
5、在物质分类中,前者包括后者的是
A.氧化物、化合物 B.化合物、电解质
C.溶液、 胶体 D.溶液、 分散系
6、下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A.空气、硫酸铜、硫酸 B.水、空气、纯碱
C.氧化铁、胆矾、熟石灰 D.硝酸、食盐水、烧碱
7、胶体区别于其他分散系的本质特征是:
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
8.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A、氢氧化钠与盐酸,;氢氧化钠与碳酸
B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液
D、石灰石与硝酸反应;石灰石与盐酸
9.下列反应既属于化合反应,又属于氧化还原反应的是
A. Fe+2HCl=H2+FeCl2 B.2FeCl2+Cl2=2FeCl3
C.CaO+H2O=Ca(OH)2 D.2Fe(OH)3 =Fe 2O3 +3H2O
10、Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
A.Na2CO3是碱 B.Na2CO3是盐 C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
11.下列物质的水溶液能导电,但属于非电解质的是
A.HClO B. Cl2 C. NaHCO3 D. CO2
12.下列说法正确的是
A、液态HCl固体NaCl均不导电,所以HCl、NaCl均是非电解质
B、NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C、铜 石墨均导电 ,所以它们均是电解质
D、蔗糖、酒精在水溶液或熔融状态下均不导电, 所以它们均是非电解质
13. 厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中
不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用盐卤(主要成分是MgCl2)点制豆腐
14.下列有关氧化还原反应的叙述错误的是
A、氧化还原反应的本质是电子的转移 B、置换反应一定属于氧化还原反应
C、在反应中不一定所有元素的化合价都发生变化
D、化合反应和复分解反应不可能有氧化还原反应
15、22克化合物A含有3.01×1023个A分子,则A的相对分子质量为
A.11 B.22 C. 44 D. 64
16、下列物质混合发生化学反应,且反应属于离子反应的是:
A.H2和O2反应生成水 B.锌片投入稀硫酸中
C.KClO3(固体)和MnO2(固体)混合加热制O2 D.NaOH溶液和K2SO4溶液混合
17.下列有关气体摩尔体积的描述中正确的是
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4L
C.标准状况下的气体摩尔体积约为22.4L
D.相同物质的量的气体摩尔体积也相同
18.下列叙述正确的是
A.NaCl的摩尔质量是58.5g B.1molNaCl的质量是58.5g·mol-1
C.58.5gNaCl所含Na+和Cl-共1mol D.1molNaCl约含有6.02×1023个Cl-
19、检验某未知溶液中是否含有SO42-离子的下列操作中,最合理的是
A.加入硝酸酸化了的硝酸钡溶液 B.加入盐酸酸化了的氯化钡溶液
C.先加硝酸酸化,再加硝酸钡溶液 D.先加入盐酸酸化,再加氯化钡溶液
20、下列各组物质相互混合后,不会发生离子反应的是
A.Na2SO4溶液和MgCl2溶液 B.Na2CO3溶液和稀硫酸
C.NaOH溶液和Fe2(SO4)3溶液 D.Ca(OH)2和盐酸
21、配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是
A、容量瓶事先未烘干 B、定容时观察液面俯视
C、定容时观察液面仰视 D、定容后,摇匀时有少量液体流出
22.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,11.2 LCO2所含的原子数为1.5NA
B.常温常压下,48g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2中所含原子数为NA
D.标准状况下,22.4LH2O含有的分子数为1 NA
23.下列各组气体或溶液用括号内试剂加以鉴别,其中合理的是
A.二氧化碳、一氧化碳、氢气(新制的澄清石灰水)
B.氧气、氢气、氮气(炽热的氧化铜粉末)
C.氯化钠、硝酸银、碳酸钠(稀盐酸)
D.硫酸、硝酸钡、氯化钾(硝酸银溶液)
![]() 24、离子方程式H++OH- H2O所表示的反应是
24、离子方程式H++OH- H2O所表示的反应是
A.所有酸和碱之间的中和反应
B.强酸溶液与强碱溶液生成可溶性盐和水的反应
C.所有可溶性酸和可溶性碱之间的中和反应
D.所有强酸和强碱之间的中和反应
25、浓度为0.01mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有C(H+)
A.0.05mol/L B.0.001mol/L C.0.002mol/L D.0.005mol/L
26.能正确表示下列化学反应的离子方程式是
A.氢氧化钡溶液与盐酸的反应OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中CO32-+2H+=H2O+CO2
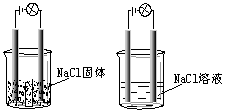 27.一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是
27.一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是
A. NaCl是非电解质
B. NaCl溶液是电解质。
C. NaCl在水溶液中电离出了可以自由移动的离子。
D. NaCl溶液中水电离出大量的离子
28、在下列反应中, HCl 作氧化剂的是
A、NaOH+HCl=NaCl+H2O B、Zn+2HCl=ZnCl2+H2↑
C、MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ D、CuO+2HCl=CuCl2+H2O
MnCl2+2H2O+Cl2↑ D、CuO+2HCl=CuCl2+H2O
29、在无色透明的酸性溶液中,下列离子能大量共存的是:
A K+ Cl- Cu2+ SO42- B Na+ SO42- Mg2+ NO3-
C Mg2+ OH- Na+ Cl- D Ca2+ CO32- K+ NO3-
30、已知 ![]() ,氯气通入硝酸银溶液中会产生白色沉淀,其反应的离子方程式是
,氯气通入硝酸银溶液中会产生白色沉淀,其反应的离子方程式是
A 、Cl-+Ag+=AgCl¯ B 、Cl2+Ag+=AgCl¯+Cl-
C 、Cl2+Ag++H2O=AgCl¯+H++HClO D 、Cl2+Ag++H2O=AgCl¯+2H++ClO-
第II卷 非选择题(共40分)
三、31.⑴、皮肤上沾有碱溶液,应用_______冲洗,再涂上_______;沾有浓H2SO4,应_______,再涂上_________.
⑵、0.6mo的氧气与0.4mol臭氧 O3质量之比为 , 分子个数之为 ,
原子个数之比为 。
⑶.在Fe3O4 +4CO![]() 3Fe+4CO2的的中, 是氧化剂, 是还原剂
元素被氧化。(每空1分,共10分)
3Fe+4CO2的的中, 是氧化剂, 是还原剂
元素被氧化。(每空1分,共10分)
32、写出下列方程式(每空2分,共6分)
⑴、硫酸铜溶液与氢氧化钠溶液混合的离子方程式
⑵、 AgNO3溶液与KCl溶液混合混合的离子方程式
⑶、写出符合离子方程式Ba2++SO42- =BaSO4↓的一种化学方程式
33、阅读下列材料后,回答相应问题。
(1)一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。 “服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中做________剂。(每空1分,共1分)
(2)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答:过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
①试分别写出Na2O2与SO3 、SO2反应的化学方程式:(每空2分,共4分)
。 。
②通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。(每空1分,共1分)
三、34、下列仪器: ①烧杯 ②蒸馏烧瓶 ③容量瓶 ④普通漏斗 ⑤分液漏斗
⑥蒸发皿 ⑦玻璃棒 ⑧铁架台(带铁圈、铁夹) ⑨酒精灯 ⑩温度计,在蒸馏时需要用到的有 (填仪器的标号,下同);在萃取时需用到的有 ;在配制一定物质的量浓度的溶液时需用到的有 。配制一定物质的量浓度的溶液时没有洗涤操作,会造成的不良后果是: (每空1分,共4分)
35.实验室中需要配制480mL0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用天平称量NaOH固态 g。称量NaOH固体需注意以下两个问题:
①因为NaOH具有腐蚀性,所以称量时,需注意选择 盛装NaOH固体;②称量必须迅速,目的是 。(每空1分,共4分)
(2)实验所需要的仪器有容量瓶(规格是: ),还有: 。(每空1分,共3分)
(3)下列操作对所配制的溶液浓度没有影响的是 。(1分)
A.称量时已观察到NaOH吸水
B.将烧杯中溶解后的溶液注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
四、36、(8分)实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
(1) 此浓盐酸的物质的量浓度是多少?(列式计算)
(2) 配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)
(3) 用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):__________。①计算②装瓶③用50 mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
化学(科)(答案)
一、选择题(本题30小题,每小题2分,共60分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | C | D | B | D | C | D | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | D | D | D | C | B | A | D | D | A |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | C | B | C | B | D | A | C | B | B | C |
二、31、(本题每空1分,共10分)
⑴、水 、硼酸(或醋酸)、 用干抹布擦去后用水冲洗 、碳酸氢钠(小苏打)。
⑵、1:1、3:2、1:1。
⑶、 Fe3O4、CO、C、Fe。(名称同样给分)
32、(本题每空2分,共6分)
⑴、 Cu2++2OH-==Cu(OH)2↓。
⑵、 Ag++Cl-=AgCl↓
⑶、 BaCl2 + H2SO4== BaSO4↓ + 2HCl (合理即可)。
33、(本题共6分)
(1)、还原剂(1分)
(2)、①、SO3+Na2O2=Na2SO4+O2;(2分)
SO2+Na2O2=Na2SO4;(2分)
②、最高(1分)
三、34、(本题每空1分,共4分)
② ⑧ ⑨ ⑩;① ⑤ ⑧;① ③ ⑦ ;会使所得溶液的浓度偏低。
35、(本题每空1分,共6分)
(1)2.00;烧杯;防止称量时间过长,NaOH吸水
(2)500mL;烧杯、量筒、玻璃棒、胶头滴管。
(3)D
四、36(本题共8分)、
(1)(3分)
C=1000×1.20×36.5%÷36.5=12.0mol/L
(2)(3分)设需浓盐酸XmL
100mL×3.00mol/L= 12.0mol/L·X
X=25 mL
(3)(2分) ①③⑥⑤④⑦⑧② 。