![]()
![]()
 高中一年级化学质量检测题试卷
高中一年级化学质量检测题试卷
| 题号 | 一 选择题 | 二 | 三 | 四 22 | 五 | 总 分 | |
| 19 | 20 | 21 | 23 | ||||
| 得分 |
|
|
|
|
|
| |
说明:园说明说明
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分满分108分,考试用时90分钟.
2.认真分析,仔细审题;答题要求规范,卷面整洁。选择题答案写在题号前答题框内. 非选择题答案写在题卷上.
3.可能用到的化学量:H
第Ⅰ卷(选择题)(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1、我国古代文明有许多发明创造对人类的进步都产生了深远的影响。下列发明创造过程中没有发生化学变化的是( )
A.指南针的使用 B.酿酒制醋 C.冶金造纸 D.烧制陶瓷
2、下列叙述中,不正确的是( )
①金属锂应保存在煤油 ②水泥可长期露置在空气中
③浓硝酸和硝酸银都必须用棕色瓶盛装并在冷暗处储存
④少量白磷储存在水中,盛有液溴的试剂瓶中也需加一些水再密封
⑤ 烧碱保存在塑料瓶中
A.仅①② B.仅②⑤ C.①②③⑤ D. ②③④⑤
3、35Cl是氯的一种同位素,下列说法正确的是 ( )
A.35Cl原子所含质子数为18
B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.
D.35Cl2气体的摩尔质量为
4、 下列说法不正确的是
A.氧化还原反应的实质是电子的得失或共用电子对的偏移
B. 在化学反应中,原子会发生变化的是核外电子数
C.硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏
D. 化学反应中的能量变化都表现为热量的变化
5、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是( )
A.烧碱 B.纯碱 C.氢氟酸 D.盐酸
6、近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是( )
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层电子都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S=2H++S2-
、
7、据报导我国科学家近年来研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是
A.它耐高温抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
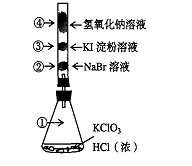 8、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对
8、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对
图中指定部位颜色描述正确的是( )
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
9、我们提倡在学习中除了接受、摩仿外,还要主动思考,不断总结;但是总结出来的规律也要经过实践检验才能决定其是否正确。下面几位同学自己总结出的结论中不正确的( )
A.式量比空气(29)小的气体不可能使用向上排空气法收集
B.单质只由一种元素组成;只由一种元素组成的物质一定是单质
C.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应类型
D.氧化还原反应中一定有元素化合价发生变化
|
A. 小苏打溶液中加入少量石灰水 Ca2+ + HCO![]() + OH
+ OH![]() = CaCO3↓+ H2O
= CaCO3↓+ H2O
B. 澄清石灰水中通入二氧化碳:Ca2+ + 2OH- + CO2=CaCO3↓ + H2O
C. 向98.3%的浓硫酸10 mL中加入
Cu + 4H+ +SO![]()
![]() Cu2+ + SO2↑+ 2H2O
Cu2+ + SO2↑+ 2H2O![]()
D. 少量金属钠与CuSO4溶液反应:2Na + Cu2+=2Na+ + Cu
11、小华家中有如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),小华利用上述用品不能完成的任务是 ( )
A.检验买来的奶粉中是否加有淀粉 B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢 D.洗去白色衣服上的番茄汁
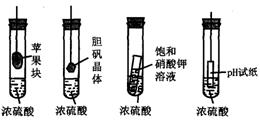 12、.在右图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是( )
12、.在右图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是( )
A. 苹果块会干瘪
B. 胆矾晶体表面有“白斑”
C. 小试管内有晶体析出
D. pH试纸变红
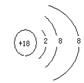
13、右图所示为元素周期表中短周期的一部分。若a原子的最外层上有5个电子,则下列说法中不正确的是 ( )
|
B.a的最高价氧化物对应的水化物比b的最高价氧化物
对应的水化物的酸性弱。
C.b的氢化物比c的氢化物稳定
D.原子半径:a>b>c
14、关于容量瓶的四种叙述:①是配制一定物质的量浓度溶液的仪器 ②不宜贮存溶液
③不能用来加热④使用之前要检查是否漏水。其中正确的是( )
A.①②③④ B.①②④ C.②③④ D.②③
15、.某同学设计实验证明NaOH溶液能使酚酞试液变红是OH-的性质,其中没有意义的是 ( )
A.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色
C.向含酚酞的20.00mL 0.10mol·L-1NaOH溶液中,滴加25.00mL 0.10mol·L-1盐酸,看颜色变化
D.向含酚酞的25.00mL 0.10mol·L-1NaOH溶液中,滴加20.00mL 0.10mol·L-1盐酸,看颜色变化
16、(CN)2的结构式为N≡C—C≡N,性质与卤素单质相似,下列有关(CN)2的说法中正确的是( )
A.NaCN与AgCN都易溶于水
B.不与氢氧化钠溶液反应
C.可用NaCN、浓H2SO4、MnO2共热制得(CN)2
D.C—C键比C≡N键稳定
17、臭氧可使湿润的淀粉KI试纸变蓝,反应为2KI+O3+H2O=2KOH+I2+O2,下列有关叙述不正确的是 ( )
A.O3与O2都是氧的同素异形体
B.该反应的电子转移总数为2e—
C.氧化产物与还原产物物质的量之比为1∶1
D.H2O既是氧化剂又是还原剂
18、密闭容器中充入CO2和CO的混合气体,混合气体的平均相对分子质量为32,容器内压强为P,然后投入足量Na2O2,不断用电火花点燃至反应停止,恢复到原温度,容器内的压强为( )
A.P B.![]() P C.
P C.![]() P D.
P D.![]() P
P
第Ⅱ卷(非选择题 共54分)
二、填空题(本题包括2小题,共23分)
19、(共16分)下表是元素周期表的一部分,针对表中的①~⑧中元素,填空回答。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)③⑤⑦元素原子形成简单离子半径由大到小的顺序是 (填离子符号)
(3)某元素二价阳离子的核外有10个电子,该元素是 (填元素名称)
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱溶液反应的
是 (填化学式)。
(5)这些元素形成的单质中,可用于制造晶体管、集成电路等电子元件的是 (填元素符号);它的氧化物可与焦炭反应生成它的单质的化学方程式为_____ _ _____。
(6 ) ④的单质与水反应的化学方程式是(并标出电子转移的方向与数目) 。
(7) ⑦元素的单质常温下的颜色是 ,并用电子式表示⑦元素的氢化物形成过程为 。
 (8)已知某些不同族元素的性质也有一定的相似性,
(8)已知某些不同族元素的性质也有一定的相似性,
 如元素①与⑤元素的氢氧化物有相似的性质,写出元
如元素①与⑤元素的氢氧化物有相似的性质,写出元
素①的氢氧化物与NaOH溶液反应的化学方
程式______________________
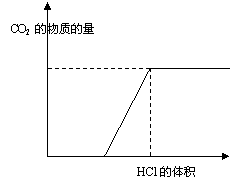
20、(7分)下图表示的是往某![]() 溶液中滴
溶液中滴
入稀盐酸产生CO2的过程。
(1)写出![]() 点以前发生反应的离子方程
点以前发生反应的离子方程
式 。
(2)写出![]() 点到
点到![]() 点发生反应的离子方程式
。
点发生反应的离子方程式
。
(3)若某![]() 溶液中含
溶液中含![]()
![]()
![]() ,向其中滴入一定
,向其中滴入一定
量的稀盐酸,恰好使溶液中![]() 和
和![]() 的物质的量之比为2:1,
的物质的量之比为2:1,
则滴入稀盐酸的物质的量等于
![]() (用
(用![]() 表示)。
表示)。
三、推断题(11分)
21、下列物质间在一定条件下可实现如图所示的一系列变化其中A是中学化学中常见的单质气体,A气体可使带火星的木条复燃,且实验室可用固体X和黑色固体Y共热来制备气体A,固体B为混合物,白色沉淀D不溶于稀硝酸,E的焰色反应显紫色(透过蓝色的钴玻璃观察),H加热分解成Y和水,请填写下列空白: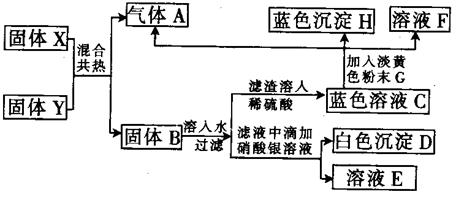
(1)写出下列物质的化学式:Y ,D ,G ,H 。
(2)写出蓝色溶液C与淡黄色粉末G反应的化学方程式:
(3)写出X与Y共热的化学方程式:
反应中Y作 ,据此可以得出的结论是 。
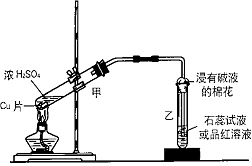
四、实验题(共14分)
22、下图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图。往试管甲中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管乙的溶液中。请回答下列问题:
(1)若试管乙中的溶液是石蕊试液,反应一段时间后,试管乙中看到的现象是____________________,表明生成的SO2气体水溶液具有_____性,SO2与水反应的化学方程式为:___________________________________。
(2)若试管乙中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管乙并在酒精灯上加热,看到的现象是_______________________________
(3)若试管乙中装的是溴水,SO2能使Br2水褪色的原因?(用离子方程式表示) :
______________ 。
(4)实验过程中,试管乙管口塞一团浸有NaOH溶液的棉花作用是用于吸收逸出的SO2,防止其污染空气。请你再举出化学实验中防止有害气体污染空气的另一种方法。
| 气体 | 防止污染空气的方法 |
(5)终止Cu与浓硫酸的反应,正确的操作顺序 ;
(6)反应结束一段时间后,在试管甲的底部常可见到一些白色固体。待试管甲内液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色。这一步操作的目的是要证实 ____________ 。
五、计算题(共6分)
23.将250mL密度为
(1)生成的氢气在标准状况下的体积。
(2)将反应后的溶液过滤,滤液稀释到500mL时FeSO4的物质的量浓度。
高中一年级化学质量检测题
参考答案
一、第Ⅰ卷(选择题)(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | A | B | D | C | C | B | A | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | D | C | A | D | C | D | D |
第Ⅱ卷(非选择题 共54分)
二、填空题(本题包括2小题,共23分)
 19.(共16分)
19.(共16分)
(1)(2分)
(2)Cl-﹥F-﹥Al3(2分) (3) 镁 (1分)
(4)Al2O3(1分)
(5)Si(1分) SiO2+ ![]() Si+2CO↑(2分)
Si+2CO↑(2分)
(6) 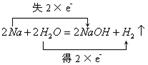 (2分)
(2分)
(7) 黄绿色(1分)
![]() (2分)
(2分)
(8) Be(OH)2+2NaOH=Na2BeO2+2H2O(2分)
20. (共7分)(1)![]() (2分)
(2分)
(2)![]() (2分)(3)
(2分)(3)![]() (每个3分)
(每个3分)
三、推断题
20题、(11分)
(1) Y CuO D AgCl G Na2O2 H Cu(OH)2 (每空1分)
(2)
2Na2O2 + 2CuSO4 + 2H2O = 2Cu(OH)2 ↓+ 2Na2SO4 + O2 ↑ (2分)
(3)方程式 2KClO3 =2KCl + 3O2 ↑ (2分)
Y作 催化剂 (1分) 结论KClO3分解制取O2的催化剂有多种 (2分)
四、实验题(共14分)
22.(14分)
(1)—变红,酸 SO2 + H2O ≒ H2SO3(4分)
(2)褪色,漂白,红色复现 (3分)
(3)Br2 + SO2 + 2H2O == 4H+ + SO42- + 2Br-(2分)
(4)(2分,只要填写一组,其他合理答案同样给分)
| NO(或NO2) | 收集法 |
| CO | 燃烧法 |
(5)先将伸进试管乙的溶液中的导管口提出液面,再熄灭酒精灯(2分)
(6)试管甲中生成的白色固体是CuSO4(1分)
五、计算题(共6分)
24.(6分)(1)
解:(1)![]() (1分)
(1分)
在反应Fe+H2SO4 FeSO4+H2↑中,铁屑足量,所以:n(H2)=n(H2SO4)
(1分)
生成的氢气在标准状况下的体积是:
![]() (1分)
(1分)
(2)反应后生成的FeSO4物质的量是:![]() (1分)
(1分)
稀释后FeSO4的物质的量浓度是:
![]() (1分)
(1分)
答:生成的氢气标准状况下的体积是
0.75mol·L-1 (1分) (其它合理解答,对照给分)