高一化学上学期期中考试
时间:100分钟 总分 :100分 命题人:吕金萍
相对原子质量:H:1 S:16 C:12 O:16 Na:23 Cl:35.5 K:39
Ca:40 Cu:64
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列叙述中错误是 ( )
A.熔点:Li>Na>K>Rb>Cs B.碱金属都能在空气中燃烧生成M2O
C.离子半径:Na+< K+ D.
与稀盐酸反应产生气体的快慢:Na2CO3 < NaHCO3
2、下列有关物质用途的叙述中,不正确的是 ( )
A.钠钾合金在室温下呈液态,是原子反应堆的导热剂.
B.氢氧化钠是一种重要的化工原料,广泛应用可肥皂、石油、造纸、纺织、印染等工业
C.过氧化钠在呼吸面具和潜水艇里作氧气的来源
D.苏打、小苏打都是发酵粉的主要成分之一
3.对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是 ( )
A.K+、Na+、Cl-、NO3- B.Na+、NO3-、SO42-、H+
C.CO32-、OH-、Cl-、K+ D.Ba2+、Na+、OH-、HCO3-
4.下列离子方程式正确的是 ( )
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水反应Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
5.下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是 ( )
A. 150 mL 2 mol·L-1 KCl溶液 B. 75 mL 2 mol·L-1 CaCl2溶液
C. 150 mL 1 mol·L-1 NaCl溶液 D. 75 mL 1 mol ·L-1 AlCl3溶液
6.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是 ( )
A.Na2O2和CO2 B.NaOH和CO2 C.Na2CO3和HCl D.Na和O2
7.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加ag。下列物质中不能满足上述结果的是 ( )
A.H2 B.CO C.CH4 D.H2 和CO的混合气
8.在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+ 4H2O中,若有1.92克Cu被氧化,则被还原HNO3的质量为 ( )
A.1.26克 B.1.89克 C.5.04克 D.3.78克
9.下列四组溶液中,不用任何试剂就能够鉴别出来的是 ( )
A.石灰水、盐酸、Na2CO3溶液 B.食盐水、稀盐酸、BaCl2溶液
C.Na2CO3、Na2SO4、BaCl2三种溶液 D.盐酸、NaCl、AgNO3三种溶液
10.下列各物质中所含原子个数由大到小的顺序正确的是 ( )
①0.5mol氨气;②4℃时9mL水;③标准状况下22.4L氦气;④0.2mol磷酸
A.①④③② B.④③②① C.①④②③ D.②③④①
11.下列说法正确的是 ( )
A.摩尔是一个基本物理量,表示物质所含粒子的多少
B.1mol氢中含有2mol氢原子和2mol电子
C.1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数)
D. Na2SO4摩尔质量是142g
12. 将28g N2与30g NO相比较,正确的是 ( )
A.分子数相等 B.氮原子数相等 C.电子数相等 D.质子数相等
13.标准状况下, NA个水分子与NA个氨分子具有相同的 ( )
①质量 ②物质的量 ③体积 ④电子数
A.①② B. ③④ C. ①③ D.②④
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.1.8g的NH4+ 离子中含有的电子数为0.1NA
B. 常温常压下,48gO3含有的氧原子数为3NA
C. 常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1 NA
15.有Fe Mg Al Cu 四种金属,若俩俩混合,取混合物26g与足量稀硫酸作用产生11.2LH2(标准状况下),则混合物可能的组成方式最多有( )
A.2种 B .3种 C. 4 种 D. 5种
16.下列叙述正确的是 ( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液。
B.将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L。
D. 将wg a%的NaCl溶液蒸发掉![]() g水,得到4a%的NaCl溶液。
g水,得到4a%的NaCl溶液。
二、填空题
17(8分)H2SO4的摩尔质量为 ,1.204×1024个H2SO4分子物质的量为 ,所含电子物质的量为 ,共含 个氧原子
18.(4分)已知硫酸溶液的浓度越大密度也越大。40%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数 (填“大于”“小于”“等于”)45%;如果是等体积混合,混合以后所得溶液的质量分数 (填“大于”“小于”“等于”)45%。
19.(8分)有两种白色粉末A.B,进行如下实验:
(1)加水时,A能溶于水而B不溶于水。
(2)加热至250℃,A能分解而B不能分解。
(3)焰色反应,A呈现紫色而B无此现象。
(4)取相同质量的A.B分别与足量盐酸反应,在相同条件下能生成相同质量的气体,且气体均为无色略带酸味,能使澄清石灰水变浑浊。
试判断A.B各为何物质,写出A.B与盐酸反应的离子方程式:
A ,B ;(用化学式填写)
A+盐酸 ;
B+盐酸 。
20、(10分)某混合物A由NaCl和BaCl2组成,为将其分离,某同学设计如下流程操作图:
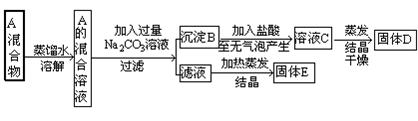 |
据此回答下列问题:
(1)用化学式写出物质B 、D、E的组成B 、D 、E ;
(2)要从E中提纯NaCl,应采用的方法是 。
反应的离子方程式为 。
三 实验题(16分)
21. 工业品纯碱中常含有少量的NaCl等杂质,图2—12中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气;②某溶液 ③纯碱样品,④稀H2SO4,⑤浓H2SO4,⑥碱石灰(碱性干燥剂),⑦碱石灰。
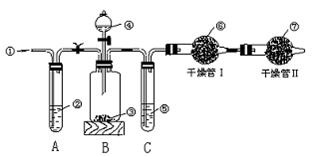 |
实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1 g)。
③准确称量一定量的纯碱的质量(设为m2 g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3 g)。
根据上述实验,回答下列问题:
(1)鼓入空气的目的是 。
(2)装置A中液体②应为 (用化学式),若撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将 (填“偏大”“偏小”或“不变”)。
(3)装置C的作用是 ,如果撤去装置C,则会导致实验结果 (填“偏大”“偏小”或“不变”)。
(4)干燥管Ⅱ的作用是 。
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是: ,如果这两步操作太快,则会导致实验测定结果 (填“偏大”“偏小”或“不变”)。
四 计算题
22. (6分)将5.0 LNaCl溶液和3.0 LBaCl2溶液混和,设混和后总体积为8.0 L,并测得NaCl物质的量浓度为0.50 mol·L-1,BaCl2物质的量浓度为0.30 mol·L-1。问:
(1)混合溶液中则Cl- 物质的量浓度为多少?(2分)
(2)混和前NaCl溶液中NaCl的物质的量浓度为多少?(2分)
(3)混和前BaCl2溶液中BaCl2的物质的量浓度为多少?(2分)
 答题卡
答题卡
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
17.(1)
18.
19. A ,B ;(用化学式填写)
A+盐酸 ;
B+盐酸 。
20.(1) 、 、
(2) 、
21(1) 。
(2) ,结果将
(3) ,结果 。
(4)干燥管Ⅱ的作用是 。
(5)其理由是 ,
结果
高一化学期中测试题参考答案
姓名 得分
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| B | D | D | D | A | A | C | A | A | C | C | A | D | B | C | B |
17.(1) 98g/mol 2mol 100mol 4.816×1024
18. 等于 大于
19. A___KHCO3_______,B________CaCO3_____;(用化学式填写)
A+盐酸___ HCO3--_+ H+=H2O+CO2___________;
B+盐酸___ CaCO3_+ 2H+__= Ca 2+_ +CO2_+ H2O _ _________。
20.(1) BaCO3 、 BaCl2 、 Na2CO3 NaCl
(2) 加入足量稀H Cl后,加热蒸发 、 CO32-_+ 2H+__= CO2_+ H2O
21 (1) 赶走残留在广口瓶中及装置里的CO2。
(2) NaOH ,结果将 偏大
(3) 除去CO2中混有的水蒸气 ,结果 偏大 。
(4)干燥管Ⅱ的作用是 吸收空气中的CO2和水蒸气 。
(5)其理由是:使反应产生的CO2能与碱石灰充分反应而完全吸收,结果 偏小
22 (1) 混合溶液中 C(Cl-) = 0.5 mol·L-1+0.3 mol·L-1×2=1.1 mol·L-1
(2) 混和前C(NaCl) = 0.5 mol·L-1 ×8 L/5L=0.8 mol·L-1
(3) 混和前 C(BaCl2)= 0.3 mol·L-1 ×8 L/3L=0.8 mol·L-1
22(1)混合溶液中则Cl- 物质的量浓度为多少?(2分)
(2)混和前NaCl溶液中NaCl的物质的量浓度为多少?(2分)
(3)混和前BaCl2溶液中BaCl2的物质的量浓度为多少?(2分)