高一年级化学第一学期期中试卷
相对原子量:H—1 C—12 N—14 O—16 Na—23 Mg—12 S—32 Cl—35.5 Mn—55 Ag—108
一.选择题(本题共40分,每小题2分,只有一个选项最符合题意,共20题)
1.化学作为一门科学始于( )
A.对燃烧现象的深入研究 B.对空气组成的研究
C.用原子—分子论来研究化学反应后 D.英国科学家汤姆生发现电子之后
2.下列说法中正确的是( )
A.人们已知道了107种元素,即已经知道了107种原子
B.互为同位素的原子,它们原子核内的中子数一定不相等
C.![]() 和
和![]() 原子中的中子数相等
原子中的中子数相等
D.质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同。
3.有人认为人体实际是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断地补充“燃料”,按照这种观点,你认为人们常摄入的下列物质不能看作“燃料”的是( )
A.淀粉类物质 B.水 C.脂肪类物质 D.蛋白质
4.下列反应中生成物总能量高于反应物总能量的是( )
A.氢气和氯气反应 B.钠在氯气中燃烧
C.氧化钙溶于水 D.红热的炭与二氧化碳反应
5.下列属于热化学方程式的是( )
A.C+ O2![]() CO2
B.C+ O2(气)
CO2
B.C+ O2(气)![]() CO2(气)+393.5千焦
CO2(气)+393.5千焦
C.C(固)+ O2![]() CO2(气)
D.C(固)+ O2(气)
CO2(气)
D.C(固)+ O2(气)![]() CO2(气)+393.5千焦
CO2(气)+393.5千焦
6.下列说法正确的是( )
A.氯化铵固体溶解于水时,溶液温度显著降低是因为只发生了扩散过程
B.含有水蒸气的气体通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的原故
C.处于不同状态下的物质所具有的能量一般是气态>液态>固态
D.在一定量的水中不断加入氯化钠固体,溶液达到饱和后,溶解过程将不再进行。
7.下列氯化物中不能直接用金属和氯气反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.AlCl3
8.下列说法中正确的是( )
A.Cl-和Cl2都是由氯元素组成的 B.Cl2有毒,Cl-也有毒
C.Cl2和Cl 原子都呈黄绿色 D.Cl-和Cl2都能与金属钠反应
9.将一支盛满氯气的试管倒立在水槽中,当日光照射相当长一段时间后,试管中最后剩余的气体约占试管容积的( )
A.![]() B.
B.![]() C.
C. ![]() D.
D.![]()
10.漂粉精的有效成分是( )
A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO3
11.下列有关实验现象的记录不正确的是( )
A.钠可以在氯气中燃烧,产生白色的烟
B.红热的铁丝可以在氯气中燃烧,产生绿色的烟
C.纯净的氢气可以在氯气中安静地燃烧,火焰苍白色
D.盛满氯气的试管倒插入氢氧化钠溶液中,一段时间后,试管内充满液体
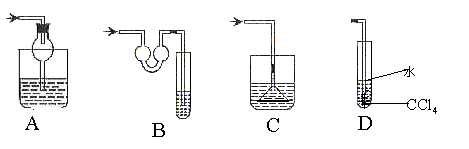
12.以下各种尾气吸收装置中,在吸收氯化氢气体时会发生倒吸现象的是( )
13.10mL 0. 1mol/L的硫酸与10mL 0.1mol/L的氢氧化钠溶液混合后,滴入紫色石蕊试液,溶液显示的颜色是( )
A.蓝色 B.红色 C.紫色 D.无色
14.下列说法正确的是( )
A.36.5克氯化氢溶解在1升水中,所得溶液浓度为1mol/L
B.22.4升氧气中不一定含有6.02×1023个氧分子
C.硫酸的摩尔质量是98
D.标准状况下,18克水的体积约为22.4升( )
15.10mL0.1mol/L的AgNO3溶液恰好使相同体积的AlCl3、MgCl2、NaCl三种溶液中的氯离子沉淀完全,则三种氯化物溶液的物质的量浓度之比为 ( )
A.2:3:6 B.3:2:1 C.1;2:3 D.1:3:6
16.5克不纯的铁溶于足量的盐酸中,在标准状况下,放出2. 24L氢气,则该铁中可能存在的杂质是( )
A.铝 B.铜 C.锌 D.银
17.下列各组物质中,分子数相同的一组是( )
A.2LCO和2LCO2 B.标准状况下22.4LH2O和1mol O2
C.0,4克H2和4.48L HCl D.18克水和标准状况下22.4L CO2
18.同温同压下,下列关于氢气和氯气的叙述中,正确的是( )
①等体积的氢气和氯气所含的分子数相同②氢分子间的平均距离和氯分子间的平均距离几乎是相等的③氢分子与氯分子的大小相同④ 氢分子和氯分子本身的大小对于气体体积影响可以忽略不计
A.①②③ B.①②④ C.①②③④ D.①④
19.NA为阿佛加德罗常数,下列说法正确的是( )
A.1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA
B.80克硝酸铵含有氮原子数为2NA
C.0.5L1mol/L的硝酸中,含离子数为0.5NA
D.1L1mol/L的蔗糖溶液中,含有的分子数为1NA
20.体积相同的某植物溶液两份,其配方如表,两份营养液中各离子物质的量浓度( )
| 成分 | KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 编号及含量 | ① | 0.3 mol | 0.2 mol | 0.1mol | 0 |
| ② | 0.1mol | 0.3 mol | 0 | 0.1mol |
A.完全相同 B.完全不同 C.仅钾离子浓度相同 D.仅氯离子浓度不同
二.填空题(本题共24分)
21.(8分)用20克烧碱配制成500毫升溶液,其物质的量浓度为 摩/升,从中取出1毫升,其物质的量浓度为 摩/升,含溶质 克。若将这1毫升溶液用水稀释到100毫升,所得溶液中溶质的物质的量浓度为 摩/升。
22. (8分)同温同压下,质量相等的二氧化硫和氧气分子个数比为 ,原子个数比为 ,体积比为 ,密度比为 。
23. (8分)有A、B、C、D三种元素,核电荷数均小于18。A和C最外层电子数相同,A的L层电子数是B和C的最外层电子数之和,B元素的电子分布在K、L、M层上。C元素的单质分子由两个原子组成,是密度最小的气态物质。D原子的最外层电子数是次外层电子数的3倍。试写出A的原子结构示意图 ,B离子的电子式 ,C原子的名称 ,D原子的电子式 。
三.实验题(本题共24分)
24.(12分)某学生发现氯水能使有色布条褪色,氯水的成分比较复杂,那么氯水中究竟什么成分具有漂白性呢?带着疑问,他作了如下探究:
⑴查找资料后得知氯水的成分有_________、__________、___________、______________,
⑵实验探究
| 序号 | 方法简述 | 现象和结论 |
| 1 | ||
| 2 |
⑶根据资料查阅和实验结果分析,可推知具有漂白性的物质是________,该物质之所以具有漂白性,与它的____ __性质有关。
⑷该学生的探究活动体现了最基本的科学研究方法,即:
![]()
25.(8分)某同学欲配制100毫升、0.2摩/升的氢氧化钠溶液,具体方案如下:
(一) 计算:需要氢氧化钠固体________。
(二) 称量:
(三) 配制:(操作顺序已被打乱)
① 向盛有氢氧化钠的烧杯中加入20毫升水使其溶解;
② 继续向A仪器中加水至液面接近刻度线2-3cm处;
③ 将冷却后的氢氧化钠溶液沿玻璃棒注入A仪器中;
④ 在烧杯中加入少量水洗涤,洗涤液也注入A仪器中,重复2-3次,轻轻摇匀;
⑤改用B仪器加水至刻度线,加盖充分摇匀。
仪器A是__ _____,仪器B是_______ ;
正确的操作顺序是__ ____ 。
(四) 问题讨论(均填“偏大”、“偏小”、“无影响”)
(1)若不用蒸馏水洗涤烧杯,则所配溶液的浓度将_______ ,若仪器A用蒸馏水洗后未烘干,则所配溶液的浓度将_______ 。
(2)定容时,俯视观察凹液面最低处与刻度线相切,则所得溶液的浓度将_______ 。
26.(4分)如图所示,烧瓶内充满干燥的氯化氢气体,
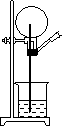 (1)当打开弹簧夹,并挤压预先盛水的胶头滴管后,可以看到
(1)当打开弹簧夹,并挤压预先盛水的胶头滴管后,可以看到
___________________________________________________
产生上述现象的原因是________________________________
(2)若喷泉实验后,水充满整个烧瓶,则所得盐酸物质的量浓度约为 __摩/升。(S.T.P)
四.计算题(本题共12分)
27.(6分)将26.1克MnO2与500毫升12摩/升的浓盐酸共热,
![]() 反应方程式为:MnO2+4HCl(浓)
反应方程式为:MnO2+4HCl(浓)![]() MnCl2+ Cl2 + 2H2O,则:
MnCl2+ Cl2 + 2H2O,则:
(1) 完全反应后可生成氯气多少升?(标准状况下)
(2) 参加反应的氯化氢的物质的量为多少?
(3) 如果不考虑氯化氢的损失,在反应后的溶液里加入过量的硝酸银溶液,能生成氯化银沉淀多少克?
28.(6分)取部分被氧化的镁带2.36克溶于60毫升2摩/升的硫酸溶液中,产生气体2.016升(标准状况下),求:
(1) 镁带中剩余镁的质量。
(2) 向反应后的溶液中加入氢氧化钠溶液,若要使沉淀量达到最大值,至少需要加入6摩/升的氢氧化钠溶液多少毫升?
高一年级化学第一学期期中试卷
一.选择题(本题共40分,每小题2分,只有一个选项最符合题意,共20题)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
![]()
![]() 二.填空题(本题共24分)
二.填空题(本题共24分)
21.(8分) 摩/升, 摩/升, 克。 摩/升。
22. (8分)分子个数比为 ,原子个数比为 ,体积比为 ,密度比为 。
23. (8分)A ,B ,C ,D 。
三.实验题(本题共24分)
24.(12分)⑴查找资料后得知氯水的成分有__ ___、 、___ __、___ ____,
⑵实验探究
| 序号 | 方法简述 | 现象和结论 |
| 1 | ||
| 2 |
⑶具有漂白性的物质是_ _,与它的_ _性质有关。
⑷
![]()
25.(8分):氢氧化钠_ _。A 是_ _, B是 _ ;
顺序是 。
(1)_ , __ ___ 。 (2)___ 。
26.(4分)(1)看到 _
原因是 __
(2)____ _摩/升。(S.T.P)
四.计算题(本题共12分)
27.(6分)
28.(6分)
参考
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | B | D | D | C | B | A | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | B | B | A | A | D | B | B | A |
一.选择题(本题共40分,每小题2分,只有一个选项最符合题意,共20题)
二.填空题(本题共24分)
21.( 8分,2×4) 1 摩/升, 1 摩/升, 0.04 克。 0.01 摩/升。
22. (8分,2×4)分子个数比为 1:2 ,原子个数比为 3:4 ,体积比为 1:2 ,密度比为 2:1 。
23. (8分,2×4)A ,B [ Cl ] ,C 氢 ,D O 。
三.实验题(本题共24分)
24.(12分,1×12)
⑴查找资料后得知氯水的成分有__氯气___、 水 、____盐酸___、___次氯酸____,
⑵实验探究
| 序号 | 方法简述 | 现象和结论 |
| 1 | 将干燥的有色布条放入装有干燥氯气的集气瓶中 | 布条不褪色,说明氯气不具有漂白性 |
| 2 | 将有色布条放入盐酸中 | 布条不褪色,说明盐酸不具有漂白性 |
⑶具有漂白性的物质是__次氯酸__,与它的_强氧化性__性质有关。
![]() ⑷
⑷
25.(8分,2+1×6):氢氧化钠_0.8克_。A 是_100_毫升容量瓶__, B是 __胶头滴管 ;顺序是①③④②⑤ 。
(1)__偏小 , __无影响_____ 。 (2)____偏大___ 。
26.(4分,1×2+2)(1)看到____烧瓶内出现红色的喷泉,最后液体充满烧瓶。__
原因是_氯化氢极易溶于水,使烧瓶内的压强减小,外界压强大于烧瓶内压强,最终把水压入烧瓶中。__
(2)______0.0446__摩/升。(S.T.P)
四.计算题(本题共12分)
27.(6分)(1)6.72L,(2)1.2mol(3)774.9克
28.(6分)(1)2.16克,(2)40毫升