高一化学寒假作业题二
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Mn:55 Br:80
第 Ⅰ 卷(选择题 共60分)
一、选择题(本题包括30小题,每小题2分,共60分。每小题只有1个选项符合题意)
1.金属钠长期露置于空气中,最终产物是( )
A.NaOH B.Na2O2 C.Na2CO3 D.NaHCO3
2.下列物质中,同时含有氯分子、氯离子、氯的含氧化合物的是( )
A.氯水 B.液氯 C.氯酸钾 D.漂粉精
3.下列各种方法中,可以用于除去苏打中混有的少量小苏打的是( )
A.水洗 B.加热 C.通入CO2 D.加入盐酸
4.标准状况下,相同质量的下列气体中体积最大的是( )
A.O2 B.Cl2 C.N2 D.CO2
5.2.3 g钠与足量氯气反应时,发生转移的电子数约为( )
A.3.01×1023 B.2.3×6.02×1023 C.6.02×1022 D.6.02×1023
6.在1 L溶有0.1 mol NaCl和0.2 mol MgCl2的溶液中,Cl-的物质的量浓度为( )
A.0.2 mol / L B.0.3 mol / L C..4 mol / L D.0.5 mol / L
7.下列有关金属铷(Rb)的叙述中,正确的是( )
A.灼烧氯化铷时,火焰呈黄色 B.硝酸铷易溶于水
C.钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是一种弱碱
8.碱金属与卤素所形成的化合物大都具有的性质是( )
①能溶于水 ②熔融态可导电 ③水溶液可导电 ④熔沸点很低 ⑤受热易分解
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
9.在下列反应的离子方程式,正确的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
B.铁屑与稀硫酸反应:Fe+2H+=Fe3++H2↑
C.少量二氧化碳通入澄清石灰水:CO2+2OH-=CO32-+H2O
D.小苏打与稀盐酸反应:H++HCO3-=H2O+CO2↑
10.将7.8g Na2O2投入100 mL水中,要计算所得溶液物质的量浓度,还需要的数据是(各元素的相对原子质量已知)( )
A.以上条件已足够 B.放出气体标准状况下的体积
C.所得溶液的体积 D.所得溶液中溶质的质量分数
11.下列物质中,属于强电解质的是( )
A.H2O B.CH3COOH C.NaHCO3 D.NH3·H2O
12.下列各组中的离子,能够大量共存于同一溶液中的是( )
A.H+、Na+、NO3-、CO32- B.H+、Na+、ClO-、Cl-
C.K+、HCO3-、Cl-、OH- D.Na+、Mg2+、NO3-、SO42-
13.X、Y均为卤族元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X单质不能将Y单质从NaY溶液中置换出来
C.X单质的熔、沸点比Y单质的熔、沸点高
D.X的气态氢化物比Y的气态氢化物稳定
14.实验室中,下列试剂的存放不正确的是( )
A.氯水需密闭于棕色试剂瓶中 B.金属钾易氧化,需保存在煤油中
C.液溴存放在试剂瓶中再加入一些水 D.单质碘易升华,需保存在酒精中
15.有下列反应:①2Fe3++2I-=2Fe2++I2 ②Br2+2Fe2+=2Br-+2Fe3+,则有关离子和分子的氧化性由强到弱的顺序正确的是( )
A.Fe3+、Br2、I2 B.Br2、Fe3+、I2 C.Br2、I2、Fe3+ D.Fe3+、I2、Br2
16.下列有关配制NaOH溶液的操作中,正确的是( )
A.天平两托盘各放一张质量相等的纸称取固体NaOH
B.在烧杯中溶解NaOH后,迅速将溶液移入容量瓶
C.容量瓶中有少量蒸馏水未干燥,即移入NaOH溶液
D.定容时加蒸馏水略超出刻度,用胶头滴管小心吸出
17.下列关于钠离子叙述中,正确的是( )
A.比较活泼,要保存在煤油中
B.比水重,所以一般存在于溶液底部
C.是钠原子的还原产物
D.在溶液中是无色的
18.同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体,则两容器内的气体一定具有相同的( )
A.分子数 B.质子数 C.质量 D.密度
19.下列实验中用错试剂的是( )
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精提取溴水中的单质溴
C.用硫酸钠除氯化钠溶液中的氯化钡杂质
D.用淀粉溶液检验久置的KI是否变质
20.b g某金属与足量稀硫酸反应,生成该金属的三价正盐和a g氢气,则该金属的相对原子质量是( )
A.2b / a B.3b / 2a C.3b / a D.a / 3b
21.下列反应中,还原剂和氧化剂是同一物质的是( )
A.H2S+SO2— B.Na+O2![]() C.Na2O2+H2O— D.S+O2
C.Na2O2+H2O— D.S+O2![]()
22.在下列各组物质中,只有还原性的是 ( )
A.Na Cl- S2- B.Cl- CO Na+
C.Fe3+ SO42- NO3- D.Fe2+ O2 H2S
23.见光能分解的盐是( )
A.HClO B.AgBr C.氯水 D.Ca(ClO)2
24.下列实验中最后无沉淀的是( )
A.将少量钾投入到CuSO4溶液中
B.将少量钠投入到NaHCO3溶液中
C.将少量Na2O2粉末投入到氢硫酸溶液中
D.将少量CO2通入石灰水中
25.对于放热反应:NaOH+HCl=NaCl+H2O ,EA、EB、EC、ED分别表示NaOH、HCl、NaCl、H2O各物质所具有的内部能量,以下说法正确的是( )
A.EA>EC B.EA>EC+ ED C.EA+EB>EC+ED D.EA+EB<EC+ED
26.下列四张图中,白球代表氢原子,黑球代表氦原子。其中表示等质量的氢气分子与氦气分子混合的是( )
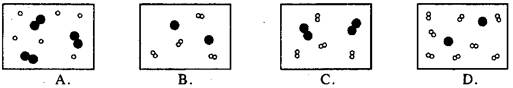
27.10g含一种杂质的碳酸钙(杂质可能是SiO2、MgCO3、Na2CO3、K2CO3)与足量盐酸反应得到4.3gCO2,则碳酸钙中可能含有( )(提示:SiO2与盐酸不反应)
A.SiO2或K2CO3 B.SiO2或MgCO3
C.MgCO3或K2CO3 D .MgCO3或Na2CO3
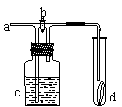 28.如右图所示,从a处通入氯气。若打开活塞b,d处的干燥有色布条褪色;若关闭活塞b,d处的干燥有色布条不褪色。下列判断不正确的是( )
28.如右图所示,从a处通入氯气。若打开活塞b,d处的干燥有色布条褪色;若关闭活塞b,d处的干燥有色布条不褪色。下列判断不正确的是( )
A.a处通入的是潮湿的氯气
B.a处通入的可能是干燥的氯气
C.c中盛放的可能是浓硫酸
D.c中盛放的可能是足量的氢氧化钠溶液
29.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
30.鉴别HCl和Cl2两种气体时,不能选用 ( )
A.AgNO3溶液
B.湿润的蓝色石蕊试纸
C.润湿的品红试纸
D.湿润的淀粉KI试纸
第 Ⅱ 卷
(非选择题 共40分)
二、(本题包括3小题,共19分)
31.(6分)2004年4月15日,某化工厂氯气储存罐发生爆炸,15万人紧急疏散。
(1)消防部门在外围用两层开花水枪向空中喷射稀烧碱溶液和水,吸收空气中的氯气,氯气与稀烧碱溶液反应的离子方程式是________________________________________。
(2)工业上用氯气和石灰乳作用制取漂粉精,反应的化学方程式为__________________________________________________;工厂使用漂粉精进行漂白时,为加快速度常加入少量稀盐酸,其原因是(用化学方程式表示)____________________________。
32.(5分)自来水常用氯气杀菌消毒。高铁酸钠(Na2FeO4)是一种新型消毒净水剂,它的氧化性比高锰酸钾更强。
(1)不法商贩用自来水冒充纯净水坑害消费者,检验方法是_____________________,反应的离子方程式是_________________________________________。
(2)下列制取高铁酸钠的化学方程式:
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O
反应中被氧化的元素是___________,若在反应中有4.5 mol电子发生转移,则生成高铁酸钠的物质的量为_________mol。
33.(8分)现有按核电荷数(均小于18)由小到大顺序排列的X、Y、Z、W四种元素,其中X原子与Z原子的最外层电子数相等。已知:
①通常状况下X、Y、W的单质为气体,其中W单质呈黄绿色,Z单质为固体;
②X单质可分别在Y、W单质中燃烧,所得产物常温下X2Y为液体、XW为气体,XW极易溶于X2Y,所得溶液可使石蕊试液变红;
③Z单质也可分别与Y、W单质反应,Z与Y可形成Z2Y和Z2Y2两种化合物,这两种化合物分别投入X2Y中可得到同一种溶液,该溶液可使石蕊试液变蓝
试回答:
(1)元素Z、W的原子结构简图是:Z______________、W_____________。
(2)X单质在W单质中燃烧的现象是_________________________________________。
(3)Z2Y2与CO2反应的化学方程式是________________________________________。
Z2Y2的主要用途是(只写两项)______________________、____________________。
(4)鉴定Z元素的化合物的实验方法是(填写名称)__________________________。
三、(本题包括2小题,共15分)
34.(8分)实验室用下图所示装置制取纯净的无水氯化铜,回答有关问题:
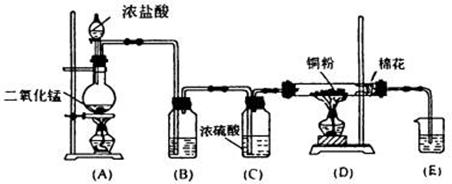
(1)装置A烧瓶中反应的离子方程式是____________________________________。
装置D玻璃管中反应的化学方程式是__________________________________。
(2)装置B中盛有水(或饱和食盐水),其作用是____________________________。
(3)装置中有两个酒精灯,实验时先点燃A中酒精灯,待观察到____________________的现象时,才能点燃D中酒精灯。
(4)反应后,D的玻璃管中固体物质的颜色为_______色,冷却后将其溶于水配成稀溶液,溶液呈______色。
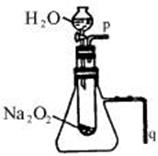 35.(7分)教材中有一个演示实验:用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧。
35.(7分)教材中有一个演示实验:用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧。
(1)由实验现象所得出的有关过氧化钠和水反应的主要结论是:
a.有氧气生成;
b.________________________________________。
过氧化钠和水反应的化学方程式是____________________________。
(2)某课外小组学生拟用图所示装置进行实验,以验证上述结论。
①验证结论a的实验方法是__________________________________。
②验证结论b的实验方法及现象是____________________________。
四、计算题(本题6分)
36.(3分)将一定体积的密度为1.84 g/cm3、溶质的质量分数为98%的浓硫酸稀释至80 mL,稀释后溶液中H+的物质的量浓度为4.6 mol/L,则所用浓硫酸的体积为多少毫升?
37.(3分)取软锰矿(主要成分为MnO2,杂质不参加反应)17.4 g与足量浓盐酸反应,将生成的Cl2通入某浓度的NaBr溶液100 mL中恰好完全反应,加热蒸发水分并烘干得残余固体11.7g。试计算:
(1)生成Cl2的体积(标准状况);
(2)NaBr溶液的物质的量浓度;
(3)软锰矿中MnO2的质量分数。
高一化学寒假作业题二
参考答案
一、(每小题2分,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | C | A | B | C | C | D | B | A | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | C | D | D | D | B | C | D | A | B | C |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 选项 | C | A | B | B | C | B | A | B | D | A |
二、(19分)
31.(1)(2分)Cl2+2OH-=Cl-+ClO-+H2O
(2)(4分)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2+2HCl=CaCl2+2HClO
32.(1)取水样,加入AgNO3溶液,有白色沉淀生成(或变浑浊)即为自来水(1分);
Ag++Cl-=AgCl↓(2分)
(2) 铁(或Fe)(1分) 1.5(1分)
33 (1)(2分)
(2)(1分)安静燃烧、苍白色火焰;
(3)2Na2O2+2CO2=2Na2CO3+O2(2分) 供氧剂、漂白剂(2分)
(4)(1分)焰色反应
三、(15分)
34.(1)(4分)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
Cu+Cl2![]() CuCl2
CuCl2
(2)(1分)除去Cl2混有的HCl
(3)(1分)D装置玻璃管中充满黄绿色气体
(4)(2分)棕黄色(或棕褐色);蓝色
35.(1)(3分)该反应是放热反应。2Na2O2+2H2O=4NaOH+O2↑
(2)①打开分液漏斗的活塞滴入几滴水,再将余烬木条靠近导管口p处,木条复燃。(2分)
②将导管q放入水中,导管口有气泡冒出。(2分)
四、(6分)
36.(3分)10 mL 37(3分).(1)2.24 L (2)2 mol / L (3)50%