高一化学寒假作业题四
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间100分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 K 39 Ca 40 Fe 56 Mn 55 Ba 137
第I卷(选择题共54分)
一.选择题(本题包括12小题,每小题2分,共24分.每小题只有一个选项符合题意.)
1、氢化钠是野外活动重要的生氢剂,其中氢元素为-1价。与水反应的化学方程式为 NaH + H2O = NaOH + H2↑,在该反应中,水的作用是:
A、还原剂
B、氧化剂
C、既是氧化剂又是还原剂
D、既不是氧化剂又不是还原剂
2、下列化学反应中,不属于四种基本反应类型的是
|
A、Fe2O3 + 3CO == 2Fe + 3CO2
B、![]()
C、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
D、CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
3、下列溶液中含Cl- 浓度最大的是
A、10 mL 0.1 mol/L 的 AlCl3溶液
B、20 mL 0.1 mol/L CaCl2溶液
C、30 mL 0.2 mol/L的 KCl溶液
D、100 mL 0.25 mol/L的 NaCl溶液
4、由阿伏加德罗定律可知:同温同压下,具有相同体积的任何气体中含有的分子数相同。在一定温度和压强下,10体积气体A2跟30体积的气体B2恰好化合生成20体积的某气体C,则该气体C的化学式为
A. AB B. A2B
C. AB3 D. AB2
5、有人认为:人体实际上是一架不断发生缓慢氧化着的“高级机器”,人体在生命过程中也需要不断地补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是
A、淀粉类物质 B、水 C、脂肪类物质 D、蛋白质
6、高空大气层中O2吸收紫外线后可变成臭氧O3,O3可按下式分解:O3 = O2 + O,O3 又和大气污染物NO发生反应: NO+ O3 == NO2+ O2 NO2 + O = NO + O2 , 最后结果2O3 = 3O2 。从反应过程和最终产物判断NO的作用是
A、氧化剂 B、还原剂 C、催化剂 D、中间产物
7、下列各组中的离子能在溶液中大量共存的是
A、H+、Ca2+、Cl-、CO32-
B、Na+、Fe3+、SO42-、OH-
C、K+、Na+、Cl-、NO3-
D、Cu2+、Ba2+、Cl-、CO32-
8、阿伏加德罗常数的单位是
A. NA B mol C. mol-1 D. 没有单位
9、24mL浓度为0.05mol·L—1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L—1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A、+6 B、+3 C、+2 D、0
10、下列化合物中,不能由两种单质直接化合生成的是
A.FeCl2 B.CuCl2 C.Na2S D.Na2O2
11、欲配制500 mL 0.4mol/L的NaCl溶液,下列操作方法正确的是
A.称取58.5 g NaCl,使其溶解于500 mL水中
B.称取28.08 g NaCl,溶于水配成500mL溶液
C.称取11.7 g NaCl,溶于适量水中再加水稀释到500mL
D. 称取11.7 g NaCl,溶于488.3 g水中
12、下列物质既能导电,又属于强电解质的一组是
A.铜片 B.熔融状态的NaCl
C.醋酸溶液 D、固体NaOH
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合项意)
13、用NA表示阿伏加德罗常数的值,下列叙述正确的是
A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B、在常温常压下,71g Cl2含有的分子数为NA
C、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D、标准状况下,11.2LH2O含有的分子数为0.5NA
14、有X、Y、Z、W四种金属单质,分别发生如下反应:(1)X + YSO4 = XSO4 + Y;
(2)Y + ZCl2 = YCl2 + Z ;(3)Z + WCl2 = ZCl2 + W。 Y、Z、W不能与XCl2反应,则四种金属单质的还原性和离子氧化性顺序为
A、还原性:X > Y > Z > W
B、氧化性:W2+>Z2+>Y2+>X2+
C、还原性:W > Z > Y > X
D、氧化性:X2+>Y2+>Z2+>W2+
15、用NA代表阿伏加德罗常数的值,以下说法正确的是
A、62g Na2O溶于水后,所得溶液中含有O2—数为NA
B、常温常压下,48 g O3含有的氧原子数为3NA
C、同温同压下,相同体积的任何气体单质所含的原子数相同
D、2.7 g金属铝变为铝离子时失去的电子数为 0.3NA
16、用NA代表阿伏加德罗常数的值,如果![]() g某气体中含有的分子数为
g某气体中含有的分子数为![]() ,则
,则![]() g该气体在标准状况下占有的体积应表示为
g该气体在标准状况下占有的体积应表示为
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
17、物质系列NaCl、 Cl2 、NaClO 、 Cl2O5 、HClO4 是按某一规律排列的。下列物质系列中也完全按此规律排列的是
A、Na2CO3 、 C、 CO、 CO2 、 NaHCO3
B、 Na2S、 S、 SO2 、H2SO3、 Na2SO4
C、 NH3、 N2、 NO、 NO2 、 NaNO3
D、P2O5 、H3 PO4、Na3 PO4、NaHPO4、NaH2PO4
18、下列说法正确的是
A、氯气、氯水和盐酸中都含有氯元素,所以它们都成呈黄绿色
B、任何发光、发热的剧烈的化学反应都可以叫做燃烧
C、氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色
D、Na在空气或氧气中加热,都能生成碱性氧化物Na2O2
19、在化合物X2Y和YZ2中,Y的质量分数分别为40%和50%,则在化合物X2YZ3中Y的质量分数约为
A.20% B.25%
C.30% D.35%
20、某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=![]() c(Na+)=c(SO42-)(c表示物质的量浓度),其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),其溶质可能是
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4
D.KCl、K2SO4、Na2SO4
21、氧化钠与过氧化钠的共同之处是
A、均是淡黄色的固体
B、均是碱性氧化物
C、与水反应后所得溶液为碱性
D、与二氧化碳反应都放出氧气
22、在含有NaCl、NaBr、NaI混合溶液中滴加足量的溴水,经充分反应后,将溶液蒸干并灼烧,得到的残渣固体为:
A、NaCl、I2
B、NaBr、NaCl和Br2
C、NaBr、NaCl和I2
D、NaCl、NaBr
第II卷 (非选择题 共46分)
三、本题包括2小题,共18分)
23、(10分)现有 ①铁片 ②NaCl ③氨水 ④醋酸 ⑤酒精 ⑥盐酸 ⑦浓H2SO4 ⑧KOH ⑨蔗糖 ⑩H2S,其中属于电解质的是 ,属于非电解质的是 ,属于强电解质的是 ,属于弱电解质的是 。既不是电解质的也不是非电解质的是 。
24、(8分)A、B、C、D、E五种物质的焰色反应都显黄色,它们按下图所示关系相互转化。
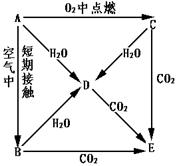 (1)写出下列物质的化学式(分子式):
(1)写出下列物质的化学式(分子式):
A B D E
(2)写出A→D、C→E反应的化学方程式:
A→D
C→E
四、(本题包括2小题。共18分)
25、(10分) 在下图所示各物质的转化中,部分生成物已略去,其中B为黑色粉末,F为黄绿色气体,A、D进行焰色反应时透过蓝色钴玻璃观察为紫色。已知:金属氧化物与浓H2SO4反应可生成氯化氢气体,如:2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
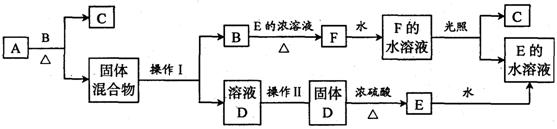
(1) 操作I包括溶解、过滤,在这两个过程中所需要的玻璃仪器有 ,
(2) 操作Ⅱ的名称为________________。
(3)写出反应A→C的化学方程式: 。
(4)若在F的水溶液中滴入碘化钾溶液,反应的离子方程式为 。
再向上述溶液中滴入CCl4,充分振荡后静置,现象为__________________________________。
26、(8分)某澄清溶液中可能存在下述几种离子:H+、K+、Ba2+、Cl-、SO2- 4、I-、CO2- 3。取该溶液进行下述实验:① 用pH试纸检验,该溶液呈强酸性;② 取部分溶液,滴几滴溴水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;③ 另取部分溶液,逐滴加入NaOH溶液,使溶液呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。根据上述实验现象判断:
(1)、原溶液中肯定存在 离子,肯定不存在 离子,可能存在 离子。
(2)、写出滴加几滴溴水后的离子反应方程式 ______ 。
五、(本题包括1小题,共10分)
27、由CuS、Ag2O组成的黑色粉末中,已知氧的质量分数为4%,求此混和物中其它元素的质量分数、两物质的质量比及物质的量之比。
化学参考答案
第I卷(选择题共50分)
一. 选择题(本题包括10小题,每小题2分,共20分.每小题只有一个选项符合题意.)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | A | C | C | B | C | C | C | B | A | C | B |
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合项意。多选、不选或错选均不给分,漏选得2分。)
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | AB | BD | A | C | B | B | AC | C | D |
第Ⅱ卷(非选择题,共50分)
三、(本题包括4小题,共18分)
23、②③④⑧⑩ ; ⑤⑨ ; ②⑧ ; ③④⑩ ; ①③④⑥⑦⑧⑨⑩ 。
24、A Na B Na2O D NaOH E Na2CO3
A→D 2Na + 2H2O == 2NaOH + H2
C→E 2Na2O2 + 2CO2 == 2Na2CO3 + O2
四、(本题包括2小题。共18分)
25、(1)普通漏斗、玻璃棒、烧杯、 (2)蒸发结晶
(3)![]()
(4)2KI + Cl2 == 2KCl + I2 CCl4层为紫红色。
26、(1) H+、Ba2+、I- CO2- 3、SO2- 4 K+、Cl-、
(2) 2I - + Br2 == 2Br - + I2
五、(本题包括2小题,共14分)
27、银的质量分数=![]()
CuS的质量分数=1-(54%+4%)=42%
铜的质量分数=42%×![]()
硫的质量分数=42%-28%=14%
CuS与Ag2S的质量比=21:29
CuS与Ag2S的物质量之比=7:4