高一化学上学期第一次月考试题
考试说明:
1、 卷共分两卷,第Ⅰ卷共15题,共50分,第Ⅱ卷共6题,共50分。
2、考试为时间90分钟,满分100分。答题只能用黑色钢笔或圆珠笔。
相对原子质量:H=1 C=12 N=14 O=16 Na=23 S=32 Cu=64 Na=23 Cl=35.5
第 Ⅰ 卷
一、选择题(每小题只有一个正确答案,每小题3分,共30分。)
1、水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是
A.过滤法 B.蒸馏法 C.分液法 D.冰冻法
2、萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②汽油 ③酒精
A.只有① B.①和② C. ①和③ D. ①②③
3、下列事故处理方法正确的是
A. 汽油失火时,立即用水灭火
B. 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火
C. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
4、已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g /mol D.32g /mol
5、实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水池中,再用水冲入下水道
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸干才停止加热。
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
6、某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中
A. 一定有SO42- B. 可能有SO42- 或Ag+ C. 一定无Ag+ D. 还可能有CO32-
7、同温同压下,等质量的下列气体所占有的体积最大的是
A.O2 B.CH4 C.CO2 D.SO2
8、现有三组溶液:①含有水份的植物油中除去水份 ②回收碘的CCl4溶液中的CCl4 ③用食用酒精浸泡中草药提取其中的有效成份。分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
9、0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的浓度之比
A.5 : 2 B.3 : 1 C.15 : 2 D.1 : 3
10、欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
二、选择题(每小题有1~2个选项符合题意,每小题4分,共20分)
11、下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
12、科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
13、下列实验操作中错误的是
A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大
14、用NA表示阿伏加德罗常数,下列叙述不正确的是
A.标准状况下,22.4LH2含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol /L的MgCl2溶液中,含有Cl- 个数为1 NA
15、下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是
A.6.72L CO B.6.6g CO2 C.1mol SO3 D.9.6g H2SO4
请把选择题的答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | * |
第 Ⅱ 卷
三、填空题
 16、(2分)现有一瓶A和B的混合液,已知它们的性质如下表。
16、(2分)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 | 熔点/oC | 沸点/oC | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A.B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: 。
17、(11分)实验室用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸。请回答下列问题:
(1)下列操作的正确顺序是(用序号表示) 。
①量取一定体积的浓硫酸 ②转移、洗涤 ③ 溶解 ④定容、摇匀 ⑤计算所用浓硫酸的体积
(2)所需要的仪器除烧杯、量筒之外,还有: 。
(3)第③步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中 ;
B. 容量瓶用蒸馏水洗涤后残留有少量的水 ;
C. 所用过的烧杯、玻璃棒未洗涤 。
18、(12分)在生产生活中,我们会遇到各种各样的化学反应,下面是其中的几个例子,请写出相应反应的化学方程式。
(1)胃舒平中含有氢氧化铝,可用来治疗胃酸(盐酸)过多
(2)实验室常用锌和稀硫酸反应制氢气
(3)将生石灰投入水中,即可得到建筑用的熟石灰
(4)实验室常用加热高锰酸钾来制氧气
19、(11分)为了除去氯化钠样品中的碳酸钠杂质,某兴趣小组最初设计了如下方案并进行了实验:
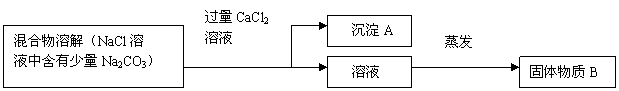
(1)写出沉淀A的化学式 ;
(2)加入CaCl2溶液后,分离除去沉淀的实验操作方法是 ;
(3)他们在实验过程中,发现了新的问题:此方法很容易引入新杂质,写出固体物质B的成分 (用化学式表示) ;
(4)他们继续探究后提出的新方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。写出有关的化学方程式:
。
四、计算题
20、(6分)某金属氯化物MCl2 40.5g,含有0.6mol的Cl-,则该氯化物的摩尔质量为 ,金属M的相对原子质量为 。
21、(8分)常温下,在27.5g水中溶解2.5g CuSO4·5H2O(式量为250),恰好达到饱和,该溶液密
度为1.50g /cm3,求:
①该溶液中CuSO4的物质的量浓度
②取出10.0 ml该溶液,配成浓度为0.1 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | B | C | D | D | B | B | C | B | B | C | A | AD | CD | BC |
三、选择题
16、蒸馏(2分)
17(1)⑤①③②④(2分)
(2)100ml容量瓶、玻璃棒、胶头滴管(3分)
(3)先向烧杯加入30ml 蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌。(3分)
(4)偏小、无影响、偏小(3分)
18、(1)Al(OH)3+3HCl=AlCl3+3H2O
(2)Zn+H2SO4=ZnSO4+H2↑
(3)CaO+H2O=Ca(OH)2
(4)2KMnO4=K2MnO4+MnO2+O2↑
19、(1)CaCO3
(2)过滤
(3)NaCl、CaCl2
(4)Na2CO3+2HCl=2NaCl+CO2↑+H2O
四、计算题
20、135g/mol、64
21、0.5mol/L、50mL