高一化学上学期第一次考试试卷
命题人:李新朵
可能用到的相对原子质量:C 12 N 14 O 16 Na 23 Al 27 S 32 Zn 65 Cu 64
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试题卷上。
4.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第Ⅰ卷 (选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
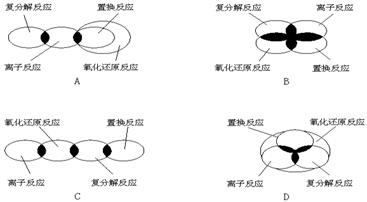
1.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是( )
2.下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态转化为游离态,该元素一定被还原
C.金属单质在化学反应中总作还原剂
D.失电子难的原子,容易获得的电子
3.下列物质中既能导电,又属于强电解质的一组物质是( )
A.石墨、醋酸溶液、食盐晶体 B.熔融状态的KOH、熔融状态的NaCl
C.稀H2SO4、NaOH溶液、纯HNO3 D.液氨、石灰水、水银
4.下列说法中,错误的是( )
A.![]() 是弱电解质,在常温下,其水溶液的
是弱电解质,在常温下,其水溶液的![]() 大于7
大于7
B.熔融状态下的氢氧化钠能导电
C.因为![]() 属于微溶物质,所以
属于微溶物质,所以![]() 是弱电解质
是弱电解质
D.水是弱电解质,液态水中,只有一部分水分子电离成![]() 和
和![]()
5.在常温下,发生下列几种反应:
①16H++10Z一+2XO4一=2X2++5Z2+8H2O ②2A2++B2=2A3++2B一 ③2B一+Z2=B2+2Z一
根据上述反应,判断下列结论中错误的是( )
A.溶液中可发生:Z2+2A2+=2A3++2Z一 B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO4一>Z2>B2>A3+ D.X2十是XO4一的还原产物
6.下列反应中,既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应
B.![]() 与
与![]() 的反应
的反应
C.灼热的炭与二氧化碳的反应 D.硫酸氢钠与氢氧化钡的反应
7. 与离子方程式![]() 相对应的化学反应可能是(以下反应均在溶液中进行)( )
相对应的化学反应可能是(以下反应均在溶液中进行)( )
A.![]() 和
和![]() 反应
B.
反应
B.![]() 和
和![]() 反应
反应
C.![]() 和
和![]() 反应
D.
反应
D.![]() 和
和![]() 反应
反应
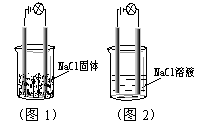 8.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
8.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
9.下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D.NaHCO3溶液中加NaHSO4溶液:HCO3--+H+=CO2↑+H2O
10.下列各组中的离子,能在溶液中大量共存,且溶液呈无色的是( )
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
11.下列说法中,错误的是( )
A.酸和碱发生中和反应的实质就是由酸电离出来的![]() 与由碱电离出的
与由碱电离出的![]() 结合生成了弱电解质
结合生成了弱电解质![]()
B.![]() 可以表示强酸与强碱发生的中和反应
可以表示强酸与强碱发生的中和反应
C.离子方程式![]() 不能代表所有的酸碱之间的中和反应
不能代表所有的酸碱之间的中和反应
D.![]() 溶液与
溶液与![]() 溶液混合,反应的离子方程式不是
溶液混合,反应的离子方程式不是![]()
12.下列说法中,错误的是( )
A.煤炭直接燃烧不仅产生大量烟尘,而且会导致酸雨形成
B.为使液体燃料充分燃烧,可以将液体燃料以雾状喷出,这保证了燃料与空气有足够大的接触面积
C.人类只有通过燃料燃烧才能获得能量
D.物质发生化学反应的同时伴随着能量的变化,它通常表现为热量变化,这就是化学反应中的放热或吸热现象
13.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合( )
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
14.在强酸性溶液中可发生如下反应:2Mn2++5R2O8x-+8H2O==16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在.在反应中充当氧化剂的R2O8x-中x的值是( )
A.0 B.1 C.2 D.3
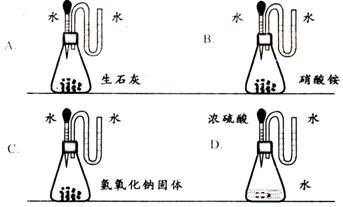
15.如图所示,挤压胶头滴管加入水或酸后,各装置“U型”管中的液柱(水)左边高于右边的是( )
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
学问二字,须要拆开看,学是学,问是问!
 高一化学上学期第一次考试试卷
高一化学上学期第一次考试试卷
高一化学
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
说明:1.答题前请将密封线内各项内容填写清楚。
2.考试结束后,只把第Ⅱ卷交回(第I卷自己保留好,以备评讲)。
选择题答题表:
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第Ⅱ卷(非选择题 共55分)
二、(本题包括包括4小题,共22分)
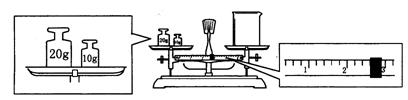 16.(4分)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是
,烧杯的实际质量为_______g.
16.(4分)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是
,烧杯的实际质量为_______g.
17.(6分)
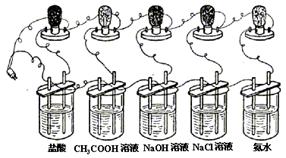
在上图所示——“比较电解质溶液的导电能力”的实验中:各个烧杯中,电极的制作材料、大小、形状、距离以及浸入溶液的深度均相同;灯泡的功率相同;烧杯中,五种溶液的体积相同,![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 的物质的量浓度相同。把仪器连接好,接通电源。观察到的现象及作出的推论是:
的物质的量浓度相同。把仪器连接好,接通电源。观察到的现象及作出的推论是:
相同条件下,连接插入_________(填写有关溶质的化学式)溶液的电极上灯泡的亮度大![]() 它们的溶液的导电能力________
它们的溶液的导电能力________![]() 它们的溶液中能自由移动的离子浓度________
它们的溶液中能自由移动的离子浓度________![]() 它们的溶液中电解质的电离程度_________。
它们的溶液中电解质的电离程度_________。
你应该注意到,该实验中使用的电解质都是一元碱、一元酸或一元碱一元酸形成的盐,由控制这样的实验条件,你想到:溶液导电性的强弱,不仅与溶液中自由移动的离子浓度大小有关,可能还与 有关。
18.(8分)化学反应都有新物质产生,同时还伴随着能量变化。
课堂上,我们曾观察过一个演示实验(如下图):在一个小烧杯里,加入约20g已研磨成粉末的氢氧化钡晶体![]() ,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后再加入约10g
,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后再加入约10g![]() 晶体,并立即用玻璃棒迅速搅拌。
晶体,并立即用玻璃棒迅速搅拌。
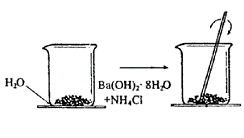
请回答下列问题:
①操作中,立即用玻璃棒迅速搅拌的目的是 ;
②发生的反应的化学方程式为 ;
③观察到的现象是 ,这个现象说明的问题是 。
19.(4分)实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种试剂一次鉴别它们。甲同学选的是一种正盐溶液,乙同学选的是一种有色试剂,他们都得到了正确结论。试推断甲、乙两位同学选用的试剂:甲_________,乙_________ 。
三、(本题包括包括4小题,共27分)
20.(4分)将氢氧化钡溶液与硫酸铜溶液混合,反应的离子方程式为
;与离子方程式![]() 相对应的化学方程式为
。
相对应的化学方程式为
。
21.(6分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们所含的物质,做了以下实验:
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀硝酸中,发现沉淀部分溶解。
试判断:固体混合物中肯定含有______ ______,肯定没有___________ _______,可能含有________ ________。
22.(9分)阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。
(1)能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有 性,铁离子具有 性;
(2)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C是 剂,具有 性;
![]()
![]()
 (3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为
;离子方程式为:
。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为
;离子方程式为:
。
(4)第(2)条信息中的CO2做 剂。
23.(8分)有化学反应:![]()
![]()
(1)在化学方程式中标出电子转移的方向和数目:![]()
![]()
(2)在上述反应中,当经 (填“氧化”或“还原”)得到的S比经 (填“氧化”或“还原”)得到的S多16g时,生成硫的总质量为 g。
四、(本题包括包括1小题,共6分)
24.(6分)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它是由焦炭在高温下与水蒸气反应制得,故又称水煤气。试解答:
(1)写出制取水煤气的主要化学方程式: (要注明反应物和生成物的状态),该反应中的还原剂是 ,已知该反应是吸热反应,则该反应中的反应物的总能量 (选填“大于”或“小于”)生成物的总能量。
(2)使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某厨房因煤气泄漏而发生爆炸事故。调查发现煤气是在达到室内原空气质量的6%时发生爆炸的,该住户煤气泄漏速率为3g/min,则爆炸时煤气已泄漏约
h。(假设厨房体积为25m3,空气密度约为![]() )(注min——分钟,h——小时)
)(注min——分钟,h——小时)
人生有一道难题,那就是如何使一寸光阴等于一寸生命!
高一化学上学期第一次考试试卷
高一化学参考答案及评分建议
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | A | C | B | C | B | C | C | C | D | D | D | C | A | C | B |
二、(本题包括包括4小题,共22分)
16. 砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了); 27.4g。(每空2分)
17.(6分)![]() 、
、![]() 、
、![]() (全部写对,2分)
(全部写对,2分)
强;大;大(每空1分,共3分) 离子所带电荷的多少(1分)
18.(8分)① 使固体反应物充分接触并起反应(2分)
② ![]() (2分)
(2分)
③ 玻璃片上的水结成了冰而将玻璃片与小烧杯粘在一起(2分)
![]() 与
与![]() 反应的过程吸收热量(2分) (每空2分)
反应的过程吸收热量(2分) (每空2分)
19.(4分)甲:碳酸钠 乙:石蕊试液 (每空2分)
三、(本题包括包括4小题,共27分)
20.(4分)![]() ;
;
![]() (答案不唯一)(每空2分)
(答案不唯一)(每空2分)
21.(6分)Na2CO3、Na2SO4 CuSO4、CaCl2 NaCl (每空2分)
22.(9分)(方程式2分,其余每空1分)(1)还原性;氧化性; (2)还原;还原
(3)Fe+2HCl=FeCl2+H2↑ ;Fe+2H+=Fe2++H2↑ (4)氧化;
23.(8分) 每空2分
(1)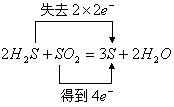 (或
(或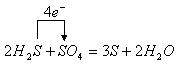 )(2分)
)(2分)
(2)氧化;还原;48(每空2分,共6分)
四、(本题包括包括1小题,共6分)
24.(6分)(1)![]() (2分);C(1分);小于(1分)
(2分);C(1分);小于(1分)
(2)![]() (2分)
(2分)