高一化学上学期第一次考试试卷
一、选择题。(每小题有一个正确答案,共60分)(答案填在表格内)
1.在科学史上中国有许多重大的发明和发现,为世界现代物质文明奠定了基础。以下发明或发现属于化学史上中国对世界重大贡献的是( )
①造纸 ②印刷技术 ③火药 ④指南针 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成牛胰岛素 ⑧提出原子——分子论学说
A. ①②③④⑧ B.②④⑥
C.①③⑤⑦ D. ⑤⑥⑦⑧
2.1998年出现的全球温度大幅度升高,产生了显著的“厄尔尼诺”现象,干旱和暴雨灾难危害了许多地区。为了防止气候变暖的进一步恶化,联合国环境保护组织于1998年通过大会要求各国减少工业排放量的气体是( )
A.二氧化硫 B.二氧化碳
C.氮的氧化物 D.氟里昂
3.下列说法中,正确的是( )
A.失去电子是还原剂,具有氧化性
B.氧化还原反应的本质是元素化合价的升降
C.阳离子只有氧化性,阴离子只有还原性
D.氧化还原反应中,某元素由化合态变为游离态,此元素可能被还原也可能被氧化
4.下面关于电解质的叙述中错误的是( )
A.在水溶液中或熔融状态下均不导电的化合物叫非电解质
B.电解质、非电解质都指化合物而言,单质不属于此范畴
C.电解质在水中一定能导电,在水中导电的化合物一定是电解质
D.纯水的导电性很差,所以水不是电解质
5.下列电离方程式中,错误的是( )
A.NaHCO3 == Na++HCO3- B.H2SO4 == 2H++SO42-
C.NaHS==Na++H++S2- D.NaHSO4==Na++H++SO42-
6.下列反应中,水做氧化剂的是( )
A.Cl2+H2O=HCl+HClO B.C+H2O![]() CO+H2
CO+H2
C.CaO+H2O=Ca(OH)2 D.CO2+H2O=H2CO3
7.下列变化,需要加入适当的氧化剂才能完成的是( )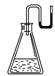
A.CuO→Cu B.Fe→FeCl2
C.H2SO4→CuSO4 D.HNO3→NO2
8.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH - =RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是( )
A.+4 B. +5 C.+6 D.+7
9.根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O====2HI+H2SO4 2FeCl3+2HI====2FeCl2+2HCl+I2
3FeCl2+4HNO3====2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO
C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
10.对于反应CaH2+2H2O===Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2是还原剂;⑤氧化产物与还原产物的分子数之比为1∶1.其中正确的是( )
A.①② B.③
C.③④ D.③④⑤
11.在 2H2S+SO2==3S+2H2O中,氧化产物与还原产物的分子数之比是( ) A.1:2 B.2:1 C.1:1 D.3:2
12.下列各组物质之间既发生离子反应又发生氧化还原反应的是( )
A.H2与O2混合点燃 B.CO2与NaOH溶液
C.铁粉与CuSO4溶液 D.C与CO2高温加热
13.能用离子方程式H++OH-=H2O表示的反应是( )
A .稀醋酸和稀氨水反应 B .稀硫酸和烧碱溶液反应
C.稀盐酸和氢氧化铜反应 D .稀硫酸和氢氧化钡溶液反应
14.下列化学反应离子方程式,不能只用Ba2++SO42-=BaSO4↓表示的是( )
A.氯化钡溶液跟稀硫酸混合 B.硝酸钡溶液跟稀硫酸混合
C.氯化钡溶液跟硫酸溶液混合 D.氢氧化钡溶液跟硫酸铜溶液混合
15.下列各组离子能在溶液中大量共存的是( )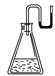
A.H+、Ba2+、NO3-、OH- B.Mg2+、Na+、Cl-、OH-
C.Na+、H+、NO3-、CO32- D.Cu2+、Fe3+、Cl-、SO42-
16.下列离子方程式中正确的是( )
A.H2SO4与Ba(OH)2溶液反应:
Ba2++OH—+H+十SO42-= BaSO4↓+H2O
B.碳酸氢钠溶液中加入盐酸 CO32- + 2H+ = CO2↑ + H2O
C.将氢氧化铁放入盐酸中 Fe(OH)3+3H+=Fe3++3H2O
D.氢氧化镁与稀硫酸反应 H+ + OH— = H2O
17. 下列实验操作中错误的是( )
A.用规格为10mL的量筒量取6mL的液体
B.用药匙或者纸槽把粉末状药品送入试管的底部
C. 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D.氢气还原氧化铜实验先加热再通氢气
18.某学生用托盘天平称量食盐时,误将食盐放在右盘,而把砝码放在左盘,这样称得食盐为15.5g(1g以下只能用游码)。由此推断,此食盐的实际质量应为( )
A.15.0g B.14.5g C.14.0g D.16.0g
19.在强酸性溶液中,可以大量共存的离子是( )
A.K+、Na+、SO42-、OH- B.NH4+、Mg2+、SO42—、Cl—
C.Na+、K+、HCO3—、Cl— D.K+、Na+、PO43-、NO3-
20.有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是( )
A.①②③④ B.①②④
C.②③④ D.①②③
答题卷
 一、选择题(20×3=60分)
一、选择题(20×3=60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | D | C | B | B | B | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | B | D | D | C | D | B | B | B |
二、填空题(30分)
![]() 21.(6分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以
21.(6分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以![]() 和
和![]() 的形式存在。
的形式存在。![]() 易被吸收,给贫血者补充铁时,应给予含
易被吸收,给贫血者补充铁时,应给予含![]() 的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的
的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的![]() 还原成
还原成![]() ,有利于人体吸收。↑
,有利于人体吸收。↑
(1)在人体中进行的转化时,①中的![]() 作_________剂,②中的
作_________剂,②中的![]() 作_________剂。还原,氧化
作_________剂。还原,氧化
(2)“服用维生素C,可使食物中的![]() 还原成
还原成![]() ”这句话指出,维生素在这一反应中作_______________剂,具有_______________性。 还原,还原性
”这句话指出,维生素在这一反应中作_______________剂,具有_______________性。 还原,还原性
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉。这些铁粉在人体胃酸(主要成份是盐酸)的作用下转化成亚铁盐。写出反应的化学方程式,标出电子转移的方向和数目:_____________________。
Fe+2HCl=FeCl2+H2↑
22.(6分)下列物质中,属于强电解质的是(填序号,下同)____ ②⑥⑩ ,属于弱电解质的是__①⑧___,既 不属于电解质也不属于非电解质的是 __④⑦_ 。
①醋酸(CH3COOH) ②苛性钠 ③氨气 ④铁 ⑤蔗糖
⑥硫酸 ⑦氨水 ⑧ 水 ⑨ 二氧化碳 ⑩硫酸钡
23.(6分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等物质组成,为鉴定成分,做了如下实验:
(1)将混合物溶于水,得无色澄清溶液;
(2)向此溶液中滴加BaCl2溶液,有白色沉淀产生
(3)过滤后,在白色沉淀中加足量稀HNO3,沉淀完全溶解。
由此推断:混合物中肯定有________,肯定没有_________,可能有_________。Na2CO3; Na2SO4、CuSO4、CaCl2; NaCl
24.(12分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH- 、NO3- 六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 。乙厂的废水中含有另外三种离子。对于该两厂的废水,可采取下列两种方法来处理。OH-、C1-、K+
(2)如果在废水中加一定量 (选填:活性炭或铁粉),
可以发生化学反应,离子方程式是 ,并且能够回收其中的金属 (填写金属元素符号)。铁粉,Fe+2Ag+=2Ag+Fe2+;Ag
![]() (3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:
;
。经过滤后的废水主要含
,可用来浇灌农田。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:
;
。经过滤后的废水主要含
,可用来浇灌农田。
Ag++Cl-=AgCl↓,Fe3++3OH-=Fe(OH)3↓,KNO3。