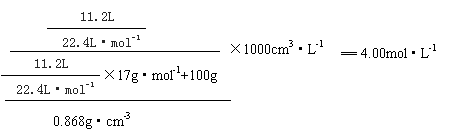高一化学上学期第二次月考试卷
命题者:李文育
1、考试时间:90分钟 满分:100分
2、请将答案写在答题卡上,写在本卷上的不计入总分。
3、本场考试不允许用计算器。
4、可能用到的相对原子质量:H—1 O—16 C—12 N—14 Na—23 S—32 Cl—35.5 Cu—64 Zn—65 Ag--108
第I卷(选择题 共52分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意,4分*8=32分。)
1.碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性问题,我国很久前已经开始实施“智力工程”,最经济可行的措施是 ( )
A.食盐加碘(盐) B.面包加碘(盐)
C.大量食用海带 D.注射含碘药剂
2.下列变化属于氧化还原反应的是:( )
A、碘的升华 B、氧化铜溶于盐酸中
C、液溴的挥发 D、次氯酸见光分解
3.同温、同压下决定气体体积的主要因素是 ( )
A、气体分子的直径 B、气体物质的量的多少
C、气体分子间的平均距离 D、气体分子的式量.
4.在标准状况下,如果1.6L氧气含n个氧分子,则阿伏加德罗常数的数值为( )
A、28n B、14n C、n/28 D、n/14
5.下列有关0.2mol/LBaCl2溶液的说法不正确的是 ( )
A、500mL溶液中Cl-离子浓度为0.2mol/L
B、500mL溶液中Ba2+离子浓度为0.2mol/L
C、500mL溶液中Cl-离子总数为0.2NA
D、500mL溶液中Ba2+和Cl-离子总数为0.3NA
6.下列说法正确的是 ( )
A.1mol任何物质都含有约6.02×1023个原子
B.12 kg12C约含有6.02×1023个碳原子
C.使用物质的量时,应用化学式指明粒子的种类
D.1mol H2的质量是1 g,它所占的体积约为22.4 L
7.下列离子方程式书写正确的是 ( )
A.碳酸钠与盐酸反应:CO32- +
2 H+![]() CO2 ↑+ H2O
CO2 ↑+ H2O
B.铁与盐酸反应:Fe +
6H+ ![]() Fe 3+ + 3 H2↑
Fe 3+ + 3 H2↑
C.二氧化碳通入次氯酸钙溶液中:
Ca2+
+2ClO-
+
CO2 + H2O![]() CaCO3 ↓+ 2 H++ 2ClO-
CaCO3 ↓+ 2 H++ 2ClO-
D.钾与水反应:K + H2O ![]() K+ + OH- + H2↑
K+ + OH- + H2↑
8.下面叙述不正确的是( )
A.漂白粉应该放在暗处隔绝空气密封保存
B.新制的氯水应该保存在棕色的玻璃试剂瓶中
C.单质碘保存在用铁盖旋紧的试剂瓶中
D.液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
二、选择题(每小题有一个或两个选项符合题意,每小题4分,共20分。)
9.标况下,20mLH2和O2的混合气体点燃充分反应后,剩余2mL气体。则原混合气体中H2和O2的体积比可能是( )
A.2∶1 B.3∶2 C.7∶3 D.3∶4
10.以下各组表示卤素及其化合物的性质变化规律中,正确的是( )
A.氧化性 F2 > Cl2 > Br2 > I2 B.还原性 F- > Cl-> Br- > I-
C.稳定性 HF > HCl> HBr > HI D.酸性 HF > HCl> HBr > HI
11.向含有1.17g NaCl和1.17g NaF的溶液中,加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥后称其质量为2.87g。根据此实验确定AgF在水中的溶解性应为 ( )
A.与AgCl一样难溶于水 B.比AgCl更难溶于水
C.易溶于水 D.无法确定
12.在臭氧(O3)发生器中装入氧气100
mL时,经过反应3O2 ![]() 2 O3(条件:放电)最后气体的体积变为95mL(以上体积都在标况下测得),则混合气体的密度是( )
2 O3(条件:放电)最后气体的体积变为95mL(以上体积都在标况下测得),则混合气体的密度是( )
A. 1.3g/L B. 1.5g/L C. 1.7 g/L D. 1.9 g/L
13.向溴化钠、碘化钾的混合溶液中通入过量氯气充分反应,将溶液蒸干,并灼烧所得物质,最后残留的固体物质是( )
A.NaCl、KCl和I2 B.NaCl和KI
C.NaBr和KCl D.NaCl和KCl
三、填空题(本题包括3小题, 共36分)
14.(4分) 已知CN-(氢氰[qing]酸根离子)和Cl-有相似之处,HCN(氰化氢)的某些性质与氯化氢相似。(CN)2(氰)与Cl2的性质有相似之处,且常温常压下也是气体。写出下列反应的化学方程式:
(1)MnO2和HCN溶液加热反应 ;
(2)(CN)2和KOH溶液反应 。
15.(6分)在配制一定物质的量浓度的硫酸溶液时,出现下列情况时溶液的物质的量浓度有何影响(选A、B、C填空:A---偏高、B---偏低、C---无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(3)配制前容量瓶用水洗涤后未进行干燥处理__________。
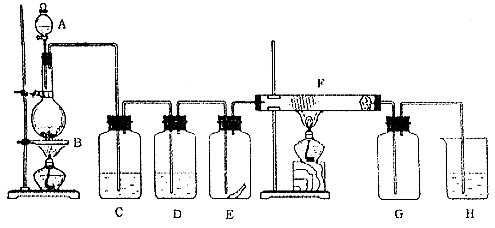
16.(每空2分,共26分。)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放一团脱脂棉。
试回答:
(1)做实验之前,应该先 ;如何操作: ;
(2)A中所放试剂为_______________,B中所放试剂为_____________,二者反应的离子方程式为_________________________;
(3)C中试剂是______ ____;D中试剂的作用是_____________ ;
(4)E中现象是_________ _; F中现象是____ ____,其反应的化学方程式为_____ __;
(5)H中试剂为___________,反应的离子方程式为________ ____ ___;
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是__________ ___。
四、计算题(本题包括2小题, 共12分)
17.(6分)某盐酸的密度为1.095g/cm3,其质量分数10.0%,试计算:
(1)该盐酸的物质的量浓度;
(2)200 mL的该盐酸与过量的锌粉充分反应,产生的氢气体积(标准状况);
(3)生成ZnCl2溶液中溶质的物质的量浓度(假设溶液体积不变)。
18.(6分)氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.860g·cm-3的氨水。求所得氨水的物质的量浓度.
答题卡
高一化学
一、二选择题(每小题4分,共52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | |||
| 答案 |
三、填空题(本题包括3小题, 共36分)
14.(4分)(1) ;
(2) 。
15.(6分).(1) ;(2) ;(3) 。
16.(每空2分,共 26分)
(1) ; ;
(2) ; ;
;
(3) ; ;
(4) ; ; ;
(5) ; ;
(6) 。
四、计算题(本题包括2小题, 共12分)
17.(6分)某盐酸的密度为1.095g/cm3,其质量分数10.0%,试计算:
(1)该盐酸的物质的量浓度;(2)200 mL的该盐酸与过量的锌粉充分反应,产生的氢气体积(标准状况);
(3)生成ZnCl2溶液中溶质的物质的量浓度(假设溶液体积不变)。
解:
18.(6分) 氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.860g·cm-3的氨水。求所得氨水的物质的量浓度。
参考答案
一、二选择题(每小题4分,共52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | B | B | A | C | A | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | |||
| 答案 | BC | AC | C | B | D |
三、填空题(本题包括3小题, 共36分)
14.(每空2分,共4分)
(1) MnO2+ 4HCN ![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
(2)(CN)2+2KOH==KCN+ KCNO+ H2O
15.(每空2分,共6分).(1)B(2)B(3)C
16.(16分)(每空2分,共26分)
(1)检查装置的气密性;把所有的出气口封好,留出H的出气口不用封,把导管插入水中,加热圆底烧瓶,一段时间后,如果有气泡产生或上升一段水柱,则说明装置的气密性良好。
(2)浓盐酸;MnO2;![]()
(3)饱和NaCl溶液; 除去Cl2中的H2O(g)
(4)黄绿色气体充满试剂瓶,红布不褪色;产生大量棕色烟;
![]() ;
;
(5)NaOH溶液;![]()
(6)先点燃B处酒精灯,待黄绿色气体充满F后,再点燃F处酒精灯。
四、计算题(本题包括2小题, 共12分)
17. (6分)解:(1) 3 mol·L-1 (2) 6.72 L (3) 1.5 mol·L-1
18.(6分)解:所得氨水的物质的量浓度为: