苏教版高一化学上学期期末考模拟试题
(必修1)
(满分:100分;时间:90分钟)
元素相对原子质量: H—1;C—12;N—14;O—16;S—32;Cl—35.5;Na—23;Mg—24;Al—27;
Fe—56;Cu—64
第Ⅰ卷(选择题 共40分)
一、选择题(每题只有一个正确答案,每题2分,共40分)
1、下列物质属于化合物的是( )
A、漂白粉 B、铝热剂 C、生铁 D、四氧化三铁
2、据报道,![]() 可能成为一种新能源,下列关于
可能成为一种新能源,下列关于![]() 的说法中:
的说法中:
①原子核中含有2个质子,3个中子;②原子核中含有1个中子,核外有2个电子
③原子核中含有2个质子,核外3个电子;④与![]() 互为同位素。正确的是( )
互为同位素。正确的是( )
A、①③ B、②④ C、①② D、③④
3、下列物质中不能通过两种单质直接化合制得的是( )
A、Na2O B、Na2O2 C、FeCl2 D、FeCl3
4、下列叙述正确的是( )
A、1 mol的O2体积一定是22.4L
B、标准状况下,22.4L的H2O约含有6.02×1023个分子
C、1 L、1 mol·L-1的MgCl2溶液中一定含有2NA(NA为阿伏加德罗常数)个Cl-
D、1 L、1 mol·L-1的HCl溶液中一定含有NA(NA为阿伏加德罗常数)个HCl分子
5、实验室制取下列气体,只能用排水法收集的是( )
A、NO B、NO2 C、Cl2 D、O2
6、水分别与下列物质反应时,水当氧化剂的是( )
A、NO2 B、SO3 C、Cl2 D、Na
7、将少量金属钠投入到CuCl2溶液中,主要反应产物是( )
A、Cu和NaCl B、H2和NaOH
C、H2、NaCl、Cu(OH)2 D、H2、NaCl、NaOH
8、下列各组中均为两瓶无标签的溶液,不使用酒精灯和任何试剂不能鉴别出来的是( )
A、NaHCO3与HCl B、Na2CO3与HCl
C、AlCl3与NaOH D、CuCl2与NaOH
9、下列固体混合物(括号内物质为杂质)不能用加热法除杂的是( )
A、Na2CO3(NaHCO3) B、Na2SO3(Na2SO4)
C、NaCl(NH4Cl) D、CaO(CaCO3)
10、氯水具有漂白性,二氧化硫也有漂白性,将SO2通入新制的氯水中所得的溶液,下列判断正确的是( )
A、漂白能力增强 B、漂白能力不变 C、漂白能力减弱 D、不能得出结论
11、将标况下22.4L的HCl气体溶于V ml的水中恰好得到10 mol·L-1的盐酸(密度为1.2g·cm-3)则V的数值是( )
A、120 B、100 C、90 D、83.5
12、下列离子反应方程式书写正确的是( )
A、用氢氧化钠溶液吸收氯气;Cl2+2OH-=Cl-+ClO-+H2O
B、用FeCl3溶液溶解单质Fe; Fe3++Fe=2Fe2+
C、用石灰石(CaCO3)与盐酸反应制CO2;CO32-+2H+=H2O+CO2↑
D、AlCl3溶液与氨水(过量)混合:Al3++4NH3﹒H2O=AlO2-+4NH4++2H2O
13、下列各组离子,在溶液中能大量共存的是( )
A、H+、Na+、Cl-、ClO- B、OH-、Ba2+、SO42-、HCO3-
C、Na+、Mg2+、SO42-、NO3- D、Fe3+、Al3+、SCN-、CO32-
14、下列实验结论错误的是( )
A、往Na2SO3溶液中加入BaCl2溶液有白色沉淀生成说明Na2SO3已变质
B、往FeCl2溶液中加入KSCN溶液,溶液显红色说明FeCl2已变质
C、将久置于空气中的Na2O固体投入稀硫酸中有气体生成说明Na2O已变质
D、将久置于空气中的KI固体投入淀粉溶液,溶液显兰色说明KI已变质
15、纳米材料是指颗粒直径为几纳米到几十纳米的材料,若把纳米碳分散到某液体中,所形成的分散系正确的是( )
A、形成黑色浊液 B、能发生丁达尔现象
C、静置时立即形成沉淀 D、纳米碳颗粒可通过半透膜
16、使含有0.1mol H2SO4的浓硫酸与过量Cu共热,所生成的气体是( )
A、0.1 mol H2 B、0.1 mol SO2
C、0.05 mol SO2 D、小于0.05 mol SO2
17、配制一定物质的量浓渡的NaOH溶液时,使所配制的溶液浓度偏小的操作是( )
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后末干燥,里面含有少量水
④读取容量瓶液面时采用俯视
A、①② B、③④ C、①③ D、②④
18、下列溶液中不与单质Cu反应(必要时可加热)的是( )
A、浓硫酸 B、稀硝酸 C、浓盐酸 D、FeCl3溶液
19、实验室贮存下列试剂方法错误的是( )
A.金属钠浸没在煤油中贮存
B.浓NaOH溶液用带磨口玻璃塞的普通试剂瓶贮存
C.浓HNO3贮存在棕色试剂瓶中
D.FeCl2溶液贮存时往溶液中加入少量铁粉
20、要将NaCl溶液中含有的少量FeCl3、AlCl3杂质除去,合理的方案是( )
A、加入过量氨水后过滤
B、加入过量的NaOH溶液后过滤
C、先加过量NaOH溶液后过滤,取滤液再通入足量CO2再过滤
D、先加过量NaOH溶液后过滤取滤液通入足量CO2再过滤,往滤液中加入适量盐酸
第Ⅱ卷(选择题 共60分)
二、填空题(共4小题,共33分)
21、(4分):选用下列物质,用A、B、C、D标号填空
A、CO2 B、SO2 C、氮氧化物 D、氟氯烃
(1)造成酸雨的主要物质是 。(2)导致光化学烟雾的物质是 。
(3)过量会导致温度效应加剧的物质是 。(4)会破坏臭氧层的物质是 。
22、(6分)(1)等质量的Na、Mg、Al分别与足量的HCl溶液反应,生成同温同压下的H2体积依次为V1、V2、V3,则它们大小的比较为 > > 。
(2)等物质的量的Na、Mg、Al分别与足量的HCl溶液反应生成同温同压下的H2体积依次为V1、V2、V3,则V1:V2:V3= 。
(3)Na、Mg、Al各1 mol(均过量),分别与1 mol·L-1的HCl溶液100mL充分反应后生成同温同压下H2体积依次为V1、V2、V3,则V1 V2 V3(用“>”、“<”或“=”填空)。
23、(12分)提纯下列物质(括号内物质为杂质),请填写所需试剂的化学式,并写出有关反应的离子反应方程式:
(1)NaHCO3溶液(Na2CO3)试剂 ;离子方程式: _____________
(2)FeCl3溶液(FeCl2) 试剂 ;离子方程式: ____________
(3)Fe(OH)3固体(Al(OH)3)试剂 ;离子方程式: ___________
(4)NO气体(NO2) 试剂 ;离子方程式: _____________
 24、(11分)在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色。(图中部分反应条件及生成物未全部标出)
24、(11分)在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色。(图中部分反应条件及生成物未全部标出)
填写下列空格:
(1)已知甲原子的质量数为23,则原子核内的中子数为 。
(2)乙元素原子的结构示意图为 。
(3)F的化学式 。
(4)写出B与乙反应生成A的离子反应方程式 _________
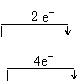
(5)写出主述反应①、反应②的化学反应方程式并标出电子转移的方向与总数
反应①: ______________
反应②: _______________
三、实验题(共2小题,共14分)
25、(5分)要分离下列四组混合物
①饱和食盐水与砂子 ②从KNO3和NaCl的混合溶液中获得硝酸钾
③水和汽油的混合物
④CCl4液体与甲苯液体(已知两者互溶,沸点分别为76.75℃和110.6℃)混合物
(1)分离①的操作是 ;分离②的操作是 ;
(2)分离③时所使用的仪器中有一种在其它组分离时无需使用,这种仪器是 ______________ ;
(3)上述四组分离时需使用酒精灯的有 ___ 和 ___ (填序号)
26、(9分)(Ⅰ)碳与浓硫酸反应为 C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O,
在该反应中浓硫酸表现 性。
(Ⅱ)某同学用下图装置进行上面反应实验并检查反应的气态产物CO2与SO2。(图中加热及夹持仪器略去)
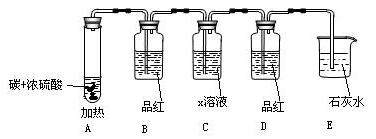
(1)证明反应生成SO2气体的现象是 ________________________________ 。
(2)C瓶在实验中的作用是 _______________ 。X应选用(填序号) 。
①NaOH溶液 ②HCl溶液 ③KMnO4溶液
(3)D瓶中品红的作用是 ______________________________ 。
实验中D瓶应有的正确现象是(填序号) _________________________________ 。
①品红褪色 ②品红不褪色
(4)证明反应生成CO2气体的现象是 _________________ ;
离子反应方程式 ___________________ 。
四、计算题(共2小题,共13分)
27、(6分)质量分数98%的浓硫酸(密度1.84g·cm-3)物质的量浓度为 mol·L-1,用这种浓硫酸配制100.00ml、1 mol·L-1的稀硫酸,需取这种浓硫酸 ml.(答案均保留小数点后一位)
28、(7分)使9.6g Cu与足量浓硝酸反应,生成NO2气体物质的量是多少?若用排水法收集可收集到标况下气体多少升?
参考答案
一、选择题(每题都只有一个正确答案,分题2分共20题;共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | D | B | C | C | A | D | C | A | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | D | A | C | A | B | D | A | C | B | D |
二、填空题(共4小题,共33分)
21、(4分)(1) B (2) C (3) A (4) D
22、(6分)(1)V3>V2>V1 (2)1:2:3 (3)V1 >V2=V3
23、(12分)(1)CO2;![]()
(2)Cl2;![]()
(3)NaOH;![]()
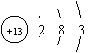 (4)H2O;
(4)H2O;![]()
24、(11分) (1)12 (2) (3)FeCl2
 (4)
(4)![]()
(5)反应①:![]()
反应②:![]()
三、实验题(共2小题,共14分)
25、(5分)(1)①过滤 ②结晶 (2)分液漏斗 (3)②、④
26、(9分)(1) 氧化性
(2):(1)B管中品红褪色
(2)除去CO2气体中的SO2、 ③
(3)检查SO2是否除尽、 ②
(4)E中石灰水变浑浊、![]()
四、计算题:(共2题,共13分)
27、(6分)18.4 5.4
28、(7分)0.3mol、2.24L