苏教版高一化学下学期复习试题
高一 ( )班 学号 姓名
1.X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X C.XH3 D.XH4
2.若ⅡA族某元素原子序数为x,那么原子序数为x+1的元素可能位于
A.VIII族 B.IB族 C.ⅡB族 D.ⅢB族
3.下列分子中所有原子都满足最外层为8个电子结构的是
A.BF3 B.CCl4 C.H2O D.PCl5
4.下列气态氢化物中最不稳定的是
A. SiH4 B. CH4 C. H2O D. HCl
5.据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的是
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池汽车的使用可以有效减少城市空气污染
D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
6.下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
7.共价键、离子键、金属键(金属离子与自由电子间的作用)、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是
A.SiO2 B.CO2 C.NaCl D.Na
8.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性
B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可推测能否将一些液体混合物用萃取的方法分离开来
9.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
10.已知离子方程式:5X—+XO3—+6H+=3X2+3H2O,若X为主族元素,据此判断:X元素的最高化合价为
A.+1 B.+4 C.+5 D.+7
11.下列说法中不正确的是
A.X+Y=M+N为放热反应,可推知X和Y的总能量一定高于M和N的总能量
B.1mol SO2的键能总和大于1mol硫和1 mol氧气的键能之和
C.由C(石墨)=C(金刚石);△H= +1.9 kJ·mol-1可知,金刚石比石墨能量低
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
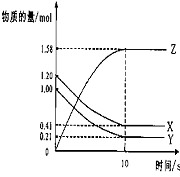 12.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
12.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B、反应开始到10s,X的物质的量浓度减少了0.79mol/L
C、反应开始到10s时,Y的转化率为79.0%
D、反应的化学方程式为:X(g)+ Y(g)![]() Z(g)
Z(g)
13.利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现
了工业化,合成气也可转化成醛、酸、酯等多种产物。下列表述不正确的是
A.以合成气为原料的反应都是化合反应
B.改变合成气中CO与H2的体积比,可以得到不同产物
C.从合成气出发生产液态烃或醇类有机物是实现“煤变油”的有效途径
D.以合成气为原料的反应产物中可能有不饱和烃或水
14.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
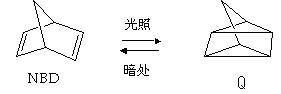
; △H = -88.62 kJ·mol-1
以下叙述不正确的是
A.NBD的化学能比Q的化学高
B.NBD和Q互为同分异构体
C.NBD能发生加成反应而Q不能发生加成反应
D.NBD不能使酸性高锰酸钾溶液褪色而Q能
15.用 A + 、B- 、C 2- 、D、E、F、G 和 H分别表示含有 18个电子的八种微粒(离
子或分子),请回答:
(1)A元素是 ___ 、B 元素是 ___ 、C 元素是 ____ (用元素符号表示)。
(2)D 是由两种元素组成的双原子分子,其分子式是 ____ 。
(3)E 是所有含 18 个电子的微粒中氧化能力最强的分子,其分子式是 。
(4)F 是由两种元素组成的三原子分子,其分子式是 ,电子式是 ________。
(5)G 分子中含有 4 个原子,其分子式是 ___ 。
(6)H 分子中含有 8 个原子,其分子式是 _____ 。
16.物质在下列变化过程中克服的是:①分子间作用力 ②共价键 ③离子键。(填序号)
(1)冰融化 ,(2)液溴挥发 ,(3)电解熔融NaCl制Na ,
(4)H2S分解生成S和H2 ,(5)碘升华 。
17.工业上用乙烯和氯气为原料经下列各步合成聚氯乙烯(PVC):
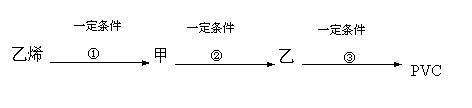 |
反应 ①、③ 的化学方程式反应类型分别为
__________________________________、____________________
__________________________________。____________________
18.可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
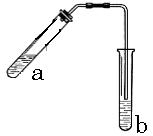 (1)试管a中需要加入浓硫酸、冰醋酸
(1)试管a中需要加入浓硫酸、冰醋酸
和乙醇各2 mL,正确的加入顺序入
操作是
|
|
|
在加热前可采取的措施是
(3)实验中加热试管的目的是:
①
②
(4) 试管b中加有饱和Na2CO3溶液 ,其作用是
(5)反应结束后,振荡试管b静置,观察到的现象是
![]()
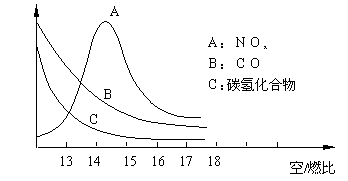 19.稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。
19.稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。
稀薄燃烧技术除能节约能源外,还
具有的优点是
(填一项)。排放到大气中的NOx
会导致酸雨、 等
环境问题(填一项)。
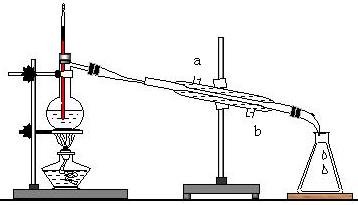 20.右图所示的是实验室
20.右图所示的是实验室
的实验,图中有 2个明显的错误:
(1)
(2)
实验中使用温度计的目的是
,
实验中冷凝水从 (填a、b)
侧进入。在 60 ~ 150 ℃收集得
到的馏分的主要成分为 。
21.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。
请填写下列空白:
(1) 与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是: 。
(2) 二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是: 。
(3) 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上发生反应的物质是: 。
22.有U、W、X、Y 4种元素:U单质常温下为双原子分子,其氢化物水溶液呈碱性; Y的单质在W2中燃烧的产物可使品红溶液褪色;X的单质是一种金属,X和W元素形成的化合物X3W4具有磁性。请回答下列问题:
(1)U的单质分子的结构式为 ;Y元素在周期表中的位置是 。
(2)W元素形成的同素异形体的晶体类型可能是 。
(3)U、W、X、Y 4种元素中有一种明显不同于其他三种的是
15.(1)K Cl S (2) HCl (3)F2 (4)H2S 电子式略
(5)PH3 (6)C2H6
16. ① ① ③ ② ①
17.CH2=CH2+Cl2→CH2ClCH2Cl 加成
![]()
![]() n CH2=CHCl→ [CH2-CHCl]n
n CH2=CHCl→ [CH2-CHCl]n
18.(1)乙醇、浓硫酸、冰醋酸 在a中放入少许碎瓷片
(2)加快乙酸乙酯的生成速率 有利于乙酸乙酯的蒸汽逸出。
(3)冷凝酯蒸气,吸收乙酸、乙醇,降低酯在水中的溶解度
溶液分上下层,上层为乙酸乙酯
19.减少CO、碳氢化合物的排放量 光化学烟雾
20.蒸馏石油 (1)温度计插入液面 (2)烧瓶中未放碎瓷片
测量馏分温度,以便收集馏分 b 汽油
21.(1)CH3CH2OH (2)2CO+4H2→CH3OCH3+H2O
(3)二甲醚
22. (1)N≡N 第三周期ⅥA族
(2)分子晶体 X