苏教版高一化学下学期期中考试试卷
命题人:虞加强
温馨提示:
l、本卷满分100分,考试时间90分钟;
2、请将试题答案全部填写在答题卷上,否则无效;
3.可能用到的相对原子质量:H--1 ; C--12 ; O--16 ;
一、选择题(本题包括25题,每题2分,共50分,每题只有一个正确答案)
1.下列有关原子核外电子的说法错误的是 ( )
A.电子不停地做高速运动; B.电子在核外是分层排布的
C.每个电子层作为最外层时,最多可容纳8个电子
D.离原子核近的电子能量低,离原子核远的电子能量高
2.元素性质呈周期性变化的根本原因是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
3.X和Y两元素的单质能化合生成XY型离子化合物,则X、Y可能位于 ( )
A.ⅠA族和ⅥA族 B.ⅡA族和ⅥA族; C.ⅡA族和ⅦA族 D.ⅥA族和ⅦA族
4.下列叙述正确的是 ( )
A.阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小;
B.共价化合物可能含有离子键; C.离子化合物中只含有离子键 ;
D.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关;
5.下列反应中生成H2的速率最快的是 ( )
| 金属 | 酸溶液 | 温度 | |
| A | Mg | 0.5mol·L━1 H2SO4 | 20℃ |
| B | Fe | 1 mol·L━1HCl | 20℃ |
| C | Mg | 2 mol·L━1HCl | 20℃ |
| D | Mg | 1 mol·L━1H2SO4 | 30℃ |
6.一定温度和压强下反应N2+3H2
![]() 2NH3达到平衡后,下列说法正确的是( )
2NH3达到平衡后,下列说法正确的是( )
A.N2与H2不再化合,NH3不再分解
B.N2、H2化合成NH3的反应速率等于NH3分解的反应速率
C.H2、NH3的体积分数相等
D.N2、H2、NH3的物质的量浓度相等
7.关于吸热反应和放热反应,下列说法错误的是 ( )
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中的能量变化,除了热能外,还可以是光能、电能等
C.化学反应过程中的能量变化,也服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应
8.下列对热化学方程式1/2H2(g) + 1/2I2(g)==HI(g) △H=+26 kJ·mol-1的叙述正确的
是 ( )
A.1 mol H2(g)和1 mol I2(g)完全反应生成2 mol HI(g)需要吸收26 kJ热量。
B.1个H2(g)分子和1个I2(g)分子完全反应生成2 个 HI(g)需要吸收52 kJ热量。
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol HI(g)需吸收52 kJ热量。
D.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol HI(g)放出26 kJ热量。
9.下图各装置中,可以构成原电池的是 ( )
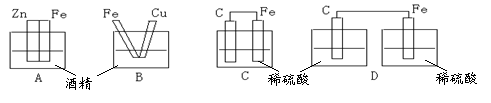 |
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是 ( )
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
11.关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级
能源; B.设法将太阳光聚焦,产生高温使水分解产生氢气;
C.寻找高效催化剂,使水分解产生氢气
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
12.天然气、石油、煤等在地球上的蕴藏量是有限的,下列说法:①可利用氢气作能源;②可用酒精作能源;③直接燃烧植物作能源;④应开发太阳能、核能等新能源。可行的是
( )
A.① B.①④ C.②③ D.①②③④
13.甲烷与氯气作用生成CHCl3的反应属于 ( )
A.置换反应 B.取代反应 C.化合反应 D.分解反应
14.点燃某气体后,在其火焰上方罩一干而冷的烧杯,烧杯内壁有水珠出现;把烧杯迅速倒
转过来,立即向杯内注入少量澄清石灰水,振荡,石灰水变浑浊。该气体可能是( )
A.CH4 ; B.H2 ; C.CO ; D.CO和O2的混合气体;
15. 下列说法错误的是 ( )
A、石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油
B、含C18以上烷烃的重油经过催化裂化可以得到汽油
C、煤是由有机物和无机物组成的复杂的混合物
D、煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
16.下列分子中的所有原子不在同一平面上的是 ( )
A.H—C≡C—H B.CH2=CH2 C.CH4 D.苯
17.将下列各种液体分别与溴水混合并振荡,不能发生化学反应,静置后混合液分成两层,溴水层几乎变为无色的是 ( )
A.氯水 ; B.己烯(化学性质类似于乙烯);
C.苯 ; D.KI溶液;
18.下列叙述错误的是 ( )
A.乙酸是有强烈刺激性气味的无色液体;
B.乙酸可用来除去热水瓶中的水垢(主要成分为碳酸钙);
C.乙酸与乙醇发生酯化反应时,浓硫酸的作用是既起催化作用又起脱水作用;
D.乙酸与乙醇发生酯化反应时,乙酸分子中羟基上的氢原子跟乙醇分子中的羟基结合生成水;
19.乙醇分子中不同的化学键如图.乙醇在一定条件下脱水能生成乙烯。下列关于乙醇
在各种不同反应里断裂键的说法错误的是 ( )
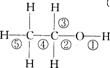 A.和金属Na反应,化学键①断裂
A.和金属Na反应,化学键①断裂
B.和金属Na反应,化学键②断裂
C.乙醇制乙烯的反应,化学键②⑤断裂
D.乙醇制乙醛的反应,化学键①③断裂
![]() 20.某有机物的结构简式为它不可能具有的性质是 ( )
20.某有机物的结构简式为它不可能具有的性质是 ( )
A.能使酸性高锰酸钾溶液褪色 B.能水解
C.能使溴的四氯化碳溶液褪色 D.能与Na2CO3溶液反应
21.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
22.下表给出几种氯化物的熔点和沸点:
| NaCl | MgCl2 | A1C13 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | —70 |
| 沸点/℃ | 1413 | 1412 | 180 | 57.57 |
下列说法能用表中数据说明的是 ( )
①氯化铝在加热时能升华;②四氯化硅在晶态时属于分子晶体;③氯化钠晶体中微粒间以分子间作用力结合;④氯化铝晶体是典型的离子晶体
A. ① ④ ; B. ① ② ; C. ② ③; D. ③④;
23.反应4NH3(g)
+ 5O2(g)![]() 4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
( )
4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
( )
A. v (O2) = 0.01mol·(L·s) –1 B.v (NO) = 0.008mol·(L·s) –1
C.v (H2O) = 0.003mol·(L·s) –1 D.v (NH3) = 0.02mol·(L·s) –1
24.1991年,我国科学家首创以铝、空气、海水为材料组成的海水电池,用作航海标志灯。该电池以取之不尽的海水为电解质,靠空气中的氧气使铝不断氧化而产生电流。下列说法正确的是 ( )
A.铝为负极.空气为正极; B.铝为负极,海水为正极
![]()
25.某气态烃1 mol,能与2 mol HCl完全加成,加成后产物分子上的氢原子又可被4 mol Cl2完全取代,则此气态烃可能是 ( )
A.HC≡CH B.CH2=CH2
![]()
二、填空题(本题共5 小题,第26题每一空格1分,其余每一空格2分,共40分)
26. (4分)有下列各组粒子或物质,请用字母回答问题:(每一空格1分)
A.氘和氚 ; B.金刚石和石墨; C.CH3CH3和CH3CH2CH2CH3 ; D.正丁烷和异丁烷; E.氯气和液氯 ; F.二氯甲烷和二氟甲烷;
(1) _____组两种粒子互为同位素。 (2) _____组两种物质互为同素异形体。
(3) _____组两种物质互为同分异构体。 (4)_____ 组两种物质互为同系物。
27、(4分)
| ⅠA |
0 | ||||||||||||||||
| ⅡA | ⅢB | ⅣB | ⅤB | ⅥB | ⅦB | ⅧB. | ⅠB | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||
| ⑦ | ⑥ | ③ | ① | ||||||||||||||
| ⑧ | ④ | ② | |||||||||||||||
| ⑤ | |||||||||||||||||
(1)上表中金属性最强的是_________(填序号)。
(2)上表中①.②. ⑤的氢化物的稳定性顺序是______________________(填写其氢化物的化学式)。
28.(12分)A、B、C、D四种短周期元素, A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号________;
(2)C的一价阴离子的结构示意图_____________________;
B的原子的结构示意图_____________________;
(3)C、D两元素形成的化合物电子式 _____________。
(4)用电子式表示A、C两元素形成的化合物的过程:______________________。
(5)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是( )。
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性
29、(12分)醋是常见的调味品,食醋中含有约3%~5%的乙酸,又称醋酸,其结构式为:
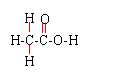

关于醋酸有下列转化关系:

(1)石油经裂解可得A,A的名称是_______________,由A生成B的反应属_____________反应 (填有机反应类型),写出反应的化学方程式_________________________________。
(2)C的结构简式是___________________。
(3)B+乙酸 ![]()
![]() D的反应类型是_______________(填有机反应类型),
D的反应类型是_______________(填有机反应类型),
写出该反应的化学方程式___________________。
30.(8分)电解原理在化学工业中有广泛应用。右下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
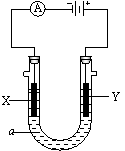 ⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为 。
②在X极附近观察到的现象是 。
⑵ 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极反应式是 。
②Y电极的材料是 。
三、计算题(第31题6分,第32题4分,共10分)
31.(6分)已知某碳氢化合物(气体)在标准状况下的密度是1.25g/L,含碳85.7% 。求该碳氢化合物的分子式,并写出该烃的结构式和结构简式。
32.(4分) 0.3 mol气态高能燃料乙硼烷(分子式B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量。
(1)写出上述燃烧反应的热化学方程式:________________________________ 。
(2)11.2 L(标准状况)乙硼烷完全燃烧生成液态水时放出的热量是多少kJ?
答题纸
命题人:虞加强
一、选择题(本题包括25题,每题2分,共50分,每题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二、填空题(本题共5小题,每一空格2分,共40分)
26. (1) _____组两种粒子互为同位素。 (2) _____组两种物质互为同素异形体。
(3) _____组两种物质互为同分异构体。 (4)_____ 组两种物质互为同系物。
27. (1)__________________(填序号)。
(2)___________________(填写其氢化物的化学式)。
28. (1)请写出A的元素符号________;
(2)C的一价阴离子的结构示意图_____________________;
B的原子的结构示意图_____________________;
(3)____________________________。 (4)___________________________。
(5)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是( )。
29. (1) A的名称是_______________, 属_____________反应 (填有机反应类型), 写出该反应的化学方程式_________________________________。
(2)C的结构简式是___________________________________________。
(3) _____________________________________________________(填有机反应类型),
写出反应的化学方程式____________________________________。
30.(1)①Y电极上的电极反应式为 __。
②在X极附近观察到的现象是 __ 。
(2) ①X电极反应式是 。
②Y电极的材料是 _______________________。
三、计算题(第31题6分,第32题4分,共10分)
31.解:
32.解:
说明:1.本卷难易适中,适用于普高学生;
2.本卷知识点考查范围:苏教版.化学必修2的专题1----专题3的酯、油脂。
3.试卷分值分布:专题1----32分;专题2----32分;专题3---36分。