高一上学期期中考化学试题.
本试卷分为第1卷(选择题)和第1I卷(非选择题)两部分, 全卷总分100分。考试时间90分钟。
可能用到的相对原子质量:H一1 C~12 0一16 Na一23 C1一35.5 Ag一108
第1卷(选择题)
一、选择题(理科:l一25小题,每小题2分,共50分。文科:l~20小题,每小题3分,共60分,每小题只有1个选项符合题意,)。
![]() 1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是
1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A
![]() B.
B.
![]() C.
C.
![]()
D
2.氧化还原反应的实质是
A.氧元素的得失 B.化合价的升降
C.电子的得失或偏移 D.有新物质生成
3、下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3C00H | NH3 | H3P04 | Fe(OH)3 |
| 非电解质 | C12H22011 | BaS04 | C2H50H | H20 |
4.关于碱金属单质的性质叙述错误的是
A.在空气中燃烧的生成物都是过氧化物 B.与水反应时都能生成碱和氢气
C.熔沸点随原子序数增加而降低 D.还原性随原子电子层数的增加而增加
5.在反应:1lP+15CuS04+24H20==5Cu3P+6H3P04+15H2S04中,7.5mo1CuS04可氧化磷原予的物质的量为
A. 1.5mol B. 3mol C.5mol D.6mol
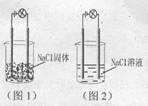 6一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接蚶线路发现灯泡亮,由此得出的结论正确的是
6一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接蚶线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B. Nacl溶液是电解质
C. NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
7 下列各物质不能与C02:反应的是
① Li20 ②Na2O2 ③Na2C03;④ NaHCO3 ⑤ Ca(OH):溶液⑥ CaCl溶液
A①③④ B.②⑤⑥ C .④⑥ D①⑥
8焰色反应是指
A可燃物在燃烧时所显示的火焰颜色
B所有元素在灼烧时都有焰色反应
C多种金属或它们的化合物灼烧时所显示的火焰颜色
D焰色反应是一种化学反应
9 下列试剂的保存或使用正确的是
A金属锂保存在煤油中,使用前要用滤纸吸干煤油
B过氧化钠比氧化钠稳定,可露置在空气中
C称量NaOH剧体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 .
D做焰色反应实验时。透过蓝色钴玻璃.观察到火焰颜色为紫色,证明被检验物中定有钾元素
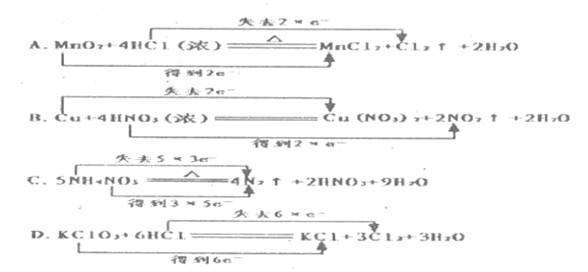
10右方化学方程式中电子转移不正确的是。
11.在氧化还原反应中3S+6KOH====K2s03+2K2S+3H20中,被氧化与被还原的硫原子数之比为:
A.1:2 B.2:1 C.1:1 D.3:2
12.已知在某温度时发生如下三个反应:(1) C+CO2=2CO (2) C+H20=CO+H2 (3)C0+H20=C02+H2 据此判断,该温度下C、CO、H2的还原性强弱顺序是:
A.CO>C>H2 B.C>CO>H2 C.C>H2>CO D.CO>H2>C
13.下列化合物溶于水后,在溶液中既存在自由移动的离子又存在溶质分子的是
A.NaCI B.CH3COOH. C.HCI O.NaOH
14.某溶液中主要含有Na+,Al3+,Cl-,S042一四种离子,已知Na+,Al3+,Cl-的个数比为3:2:l,则溶液中Al3+-与S042一的个数比为
A.1:2 B.1:4 C.3:4 D.3:2
15.下列关于碳酸氢钠的叙述,不正确的是 .
A.它是一种白色粉末,易溶于水 B.其分子式为NaHC03·lOH20,在空气里易风化、
C.可以跟氢氧化钠起反应,生成正盐
D.与碳酸钠相比,若质量相同,分别跟足量的盐酸反应,碳酸氢钠得到的C02多
16.只用一种试剂就可以将BaCl2、NaCl KOH三种溶液区别开,此试剂是
A.Na2C03 B.盐酸 C.硫酸 D.CuS04"~
17.下列反应的离子方程式不正确的是
A.Na2C03与Ba(0H)2溶液混合:C032一+Ba2+=BaC03 ↓
B。NaHC03与足量澄清石灰水混合:HCO-+Ca2++ OH一== CaC03↓ +H20
C.Na投入冷水中:Na+H20====Na++0H一+H2 ↑
D.Na2C03与足量盐酸作用:C032一+2H+=C02 ↑+H20
18.钾和另一种碱金属的合金8 g与水完全反应后放出O.4 g氢气,合金中另一种金属一定是 ’
A.锂 B.钠 C.铷 D.铯
19.下列各项中的两种物质在溶液中的反应可用同一离子方程式表示的是
A.醋酸与氢氧化钠、盐酸与氢氧化钡溶液 、
B.碳酸钠与足量盐酸、碳酸氢钾与足量稀硫酸
C.硫酸与氢氧化钡溶液、NaHS04溶液中滴入少量Ba(0H)2
D.碳酸钠与澄清石灰水、碳酸氢钠与澄清石灰水
20.实验表明,Ca比Na更易失电子,但将Ca、Na投入水中时,Na与水作用要比Ca与水作用激烈,其原因是
A.Na最外层电子数少
B.Na原子半径比Ca原子半径小
C.金属活动顺序表中Na与Ca的顺序颠倒了
D.反应产物Ca(0H)2溶解度小于NaOH,Ca(0H)2覆盖在钙的表面,影响了Ca与水反应的速率
21.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠同体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H1206 D.C12H22O11
22.下列叙述中正确的是
A.需加热的反应都是吸热反应 B.放热反应不需要加热或点燃条件
C.化合反应一般都是放热反应 D.分解反应一般都是放热反应
23.下列物质中含有自由移动的Cl-的是
A.KClO3溶液 B.MgCl2溶液 c.液态HCl D.固态NaCl
24.在加入少量铁粉能产生氢气的溶液中,下列离子能大量共存且溶液为无色的是
A..NH4+,Cu2+,SO42-,CI— B.K+,Fe3+,Cl-,OH—
C.K+,Na+,CO32-,SO42-。 D.Na+,K+,Cl一,SO42-;_
25.在含有Cu(NO3)2,Mg(N)2和AgNO3 的溶液中加入适量锌粉,首先置换出的是
A.Mg B.Cu C .Ag D.H2
答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
第1I卷(非选择题).
注意:文科做26、27、28、30题,共40分,每空2分。
理科全做。50分,26-29题每空1分,30题每空2分,3 1题7分,32题6分。
二、填空题
26、.已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
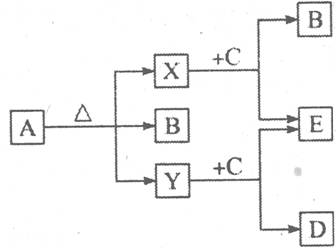
(1)写出下列物质的化学式:
A、 ,B ,C D ,E
(2)写出A受热分解的化学方程式:
27、(12分)(1)Na2CO3固体中混有少量NaHC03固体,除去的方法 ,反应的是化学方程式为
(2)NaHC03溶液中混有少量Na2C03,除去的方法是 ,反应的离子方程式为
(3)NaOH溶液中混有少量Na2C03,除去的方法是 ,反应的离子方程式为
(4)C02中混有少量的S02,除去的方法是 方程式为反应的化学
28.有一包白色固体,可能含有Na+、K+、Ca2+、Cu2十、MnO2、C1一、CO3一,现做如下实验:
①将少量固体放入水中,搅拌,静置,得无色溶液且底部有白色沉淀。
②过滤,向沉淀中加盐酸,沉淀全部溶解并产生气体。
③取少量滤液,加入AgNO3;溶液有白色沉淀产生,再加稀HN03,沉淀部分溶解并有气体放出。
请完成下列问题:
(1)白色固体中一定含有的离子是 ,一定没有的离子是
(2)白色固体中可能含有的离子是 ,如检验其是否存在,还需进行的实验操作是
29、我国化学家侯德榜根据NaHCO3的溶解度比NaCl、Na2COa、.NH4C1都小的性质,运用NaCl + C02+ NH3 + +H20=== NaHCO3+ NH4C1等反应原理,发明了“侯氏制碱法"。根据侯德榜制碱法原理,实验室用食盐、氨水、大理石、盐酸制取碳酸钠。其实验过程如~F:①配制含氨的氯化钠饱和溶液;②用石灰石和稀盐酸制取纯净的C02;③将C02通入NaCl的氨溶液中,得到碳酸氢钠晶体;④过滤,,冷水洗涤沉淀;⑤焙烧NaHC03得到
Na2C03。
试回答下列问题:
(1)某学生将实验步骤①、②、③设计成下图所示的装置:
洗气瓶B中的液体是 ,烧杯C中的液体是 。装置A中的离子方程式是
(2)实验步骤④中过滤操作要求做到“一贴、二低、三靠”,其具体含义是:
一贴:
二低:
三靠:
洗涤沉淀的目的是
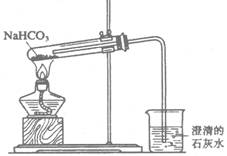 (3)该学生设计右图所示装置进行NaHC03的分解,并证实产物中有C02产生。
(3)该学生设计右图所示装置进行NaHC03的分解,并证实产物中有C02产生。
①试管中发生的化学反应方程式是:
②指出该学生设计的装置图的错误之处,并改正(文字说明即可)。
③停止加热时应该怎样操作,为什么?
④烧杯中发生反应的离子方程式是;
30.将a g钠溶于b g水中,al gNa20溶于b1 g水中,a2gNa202溶于b2 g水中,均得溶质质量分数为8%的溶液。
(1)若al:a2=31:39,则bl:b2=
(2)若a为4.6,则b=
三、计算题(1 3分)
3 1. (7分)今有Na2C03、NaHC03和NaCl的混合物100 g,加热到质量不再减少为止,其剩余残渣为84.5 g;将残渣溶于水,滴入足量AgN03溶液得到白色沉淀,加足量稀硝酸后大部分沉淀消失,剩余沉淀为12.26 g。试计算混合物中Na2C03、NaHCO:3和NaCl的质量分数各是多少。
32.(6分)将7.8gNa.202投入到lOOgl0%的苛性钠溶液中充分反应。求:.
(1)所得溶液的质量分数
(2)向该溶液中通入一定量C02,然后小心蒸干,所得固体冷却干燥,称重为28.5克,通过计算推出该固体物体的组成和质量。
答案
一、选择题(理科:1-25小题,每小题2分,共50分。文科:1-20小题,每小题3分,共60分。每小题只有1个选项符合题意,)
1、D 2、C 3、C 4、A 5、A 6、C 7、C 8、C 9、D 1 0、D 1 1、A l 2、B 13、B 14、A 15、B
16、D 17、C 18、A 19、C 20、D 21、D 22、C 23、B 24、D 25、C
注意:文科做26、27、28、30题,共40分,每空2分。 理科全做。50分,26-29题每空i分,30题每空2分,3l题7分,32题6分。
26、(1)NaHC03 Na2C03 Na202 NaOH 02 (2) 2NaHC03=△==Na2C03十C02↑十H20
27、(1)加热 2NaHC03====Na2C03+H20+C02 ↑
(2)在溶液中通入过量C02; CO32- +C02+H20:===2 HC03
(3)滴入适量的Ca(OH)2溶液 CO32-+Ca2+=CaC03 ↓
(4)将混合气体通入饱和NaHC03溶液S02+2NaHC03====Na2S03+2C02+H20
28、(1) Ca2+、 CO32-、Cl— Cu2+、MnO4-
(2)Na+、K+ 焰色反应
29、(1)饱和NaHC03溶液(水或NaHC03也正确) NaCl的氨溶液 CaC03+2H十=Ca2十+C02 ↑+H20
(2)滤纸紧贴漏斗;滤纸低于漏斗、液面低于滤纸;烧杯靠玻棒、玻棒靠(三层)滤纸、漏斗口靠烧杯。 洗去晶体吸附的杂质。
(3)①2NaHC03=Na2C03+H20+C02 ↑ ②试管内导管太长,伸出活塞即可;试管口应略向上
倾斜③先撤除导管,再熄灭酒精灯,否则易使烧杯中的液体倒吸进入热试管二使其破裂。 ④
Ca2++20H一十C02-=CaC03↓+H20
30。(1)1:1 (2)95.6
31、混合物中NaHC03的质量分数为42%,Na2C03的质量分数为53%,NaCl的质量分数为5%。
32。(1)17% (2)NaHC03 12.6g Na2C03 1 5.9g