高一上学期期中考试化学试题
(110分 100分钟完成)
命题人:李文才
注意:请将1——20题答案填入答题卡。
单选题(3分×14=42分)
1.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是:
A.一个D2O分子所含的中子数为8 B.NH3含有极性共价键
![]() C.HCl的电子式为
D.热稳定性:H2S>HF
C.HCl的电子式为
D.热稳定性:H2S>HF
2.下列叙述正确的是:
A.生成物只有一种的反应不一定是化合反应
B.有电解质参加的反应一定可以用离子方程式表示
C.化学反应中能量的变化都以热能形式表现出来
D.放热反应在常温下一定很容易发生
3.用高能![]() 核轰击
核轰击![]() 核,发生核合成反应,得到新原子
核,发生核合成反应,得到新原子![]() ,该原子中中子数与核外电子数之差为:
,该原子中中子数与核外电子数之差为:
A.161 B.53 C.108 D.55
4.同主族两种元素原子的核外电子数的差值可能为:
A.6 B.12 C.30 D.26
5. SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子
均满足8电子结构。下列说法正确的是 :
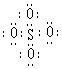 A.SO42-的电子式为:
A.SO42-的电子式为:
B.S2O82-中没有非极性键 C.S2O82-有强氧化性 D.S2O82-中硫为+7价
6.质量分数不同的两种酒精溶液,以相同质量混合时,所得混合溶液密度为ρ1;以相同体积混
合时,所得混合溶液密度为ρ2。则ρ1、ρ2之间大小关系正确的是:
A.ρ1>ρ2 B.ρ1=ρ2
C.ρ2>ρ1 D.不能确定
7.在一定条件下,RO3n--和氟气可发生如下反应:RO3n-- + F2 + 2OH-- = RO4-- + 2F-- + H2O
则下列说法正确的是 :
A.R位于ⅤA族 B.R2在常温常压下一定是气体
C.R元素的最低化合价为-1价 D.n=2
8. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数):
A.若R(OH)m为强碱,则W(OH)n也一定为强碱
B.若X 的最高正化合价为+5,则五种元素都是非金属元素
C.若Y的最低化合价为-2,则Z 的最高正化合价为+6
D.若HnXOm 为强酸,则Y是活泼非金属元素
9.下列说法正确的是:
A.用酒精或CCl4可提取碘水中的碘单质
B.NaCl和SiC的化学键类型相同
C.H2S和SiF4分子中各原子最外层都满足8电子结构
D.24Mg32S晶体中电子总数与中子总数之比为1∶1
10.下列说法正确的是:
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.离子化合物一定含非金属元素
11.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
12.下列有关说法一定正确的是:
A.联合制碱和侯德榜制碱的最终产品相同,都是碳酸氢钠
B.等质量的碳酸钠和碳酸氢钠分别与100mL1mol·L-1的盐酸反应时,碳酸氢钠放出的二氧化碳多
C.工业上可以将氢气和氯气混合光照制取氯化氢
D.氧化等量的SO2,消耗ICl和Br2的物质的量不等
13.已知硅在自然界中有3种同位素,![]() ,
,![]() ,
,![]() .硅的近似相对原子质量为28.1,下列关于
.硅的近似相对原子质量为28.1,下列关于
![]() 原子的物质的量分数的说法,正确的是:
原子的物质的量分数的说法,正确的是:
A.小于90% B.大于90% C.等于90% D.无法判断
14.两种短周期元素X和Y可组成化合物![]() ,当Y的原子序数为m时,X的原子序数为:
,当Y的原子序数为m时,X的原子序数为:
①m+8 ②m-2 ③m+6.其中正确的组合是:
A.①②③ B.只有① C.只有②③ D.只有①③
非选择题(共68分)
15.(10分)下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。
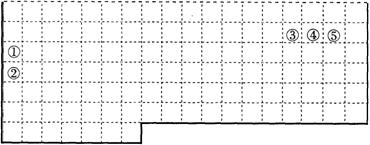 (1)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(1)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(2)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
A.元素①的单质
B.元素②的单质 C.元素①②形成的合金 D.无法判断
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致
密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(d)比较这两种元素的气态氢化物的稳定性
16.(9分)A+、B+、C--、D、E五种粒子(分子或离子),都分别含有10个电子,已知它们有如下转换关系:①B+ + C-- = 2D ②A+ + C-- = D + E↑,则:
 (1)用电子式表示D的形成过程____________________________________。
(1)用电子式表示D的形成过程____________________________________。
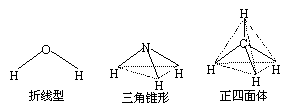
(2)已知H2O、NH3和CH4空间构型分别为折线型、三角锥形和正四面体(如右图,其中实线为化学键)。
①若把原子数相等、最外层电子总数也相等的粒子(分子或离子)叫等电子体,等电子体具有相同的结构,则B+的空间构型为_________________。
②若F是一种含18电子的正四面体分子,则比F分子稳定的18电子分子(均含两种元素)有
______________________(写出两种即可)。
17.(13分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D
同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。
试回答下列问题:
(1)A在周期表中的位置_________________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(3)A、C、D形成的化合物CD2、D2A、DA2中,各原子都满足最外层8电子结构的是__________________(请填写具体的化学式);B2A2所含化学键的类型有________________________。
(4)CA2与含1.5 molD的一种含氧酸(该酸的某盐在有催化剂存在的条件下常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,则该反应的化学方程式是______________________________________。
18.(14分)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球。
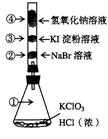 (1)反应一段时间后,对图中指定部位颜色描述正确的是_____。
(1)反应一段时间后,对图中指定部位颜色描述正确的是_____。
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
(2)写出锥形瓶中反应的离子方程式_____________________________________;若用K37ClO3和H35Cl反应,则生成的氯气的相对分子质量为__________(保留三位有效数字)。
(3)若将锥形瓶中的试剂改为MnO2和浓盐酸反应,也可以完成上述实验,则除了增加必要的固定装置外,还需要的主要仪器和用品是________、________。实验中若用21.75gMnO2(87g·mol--1)和100mL10mol·L--1的浓盐酸反应,充分反应后生成Cl2的体积______________L(标准状况)。
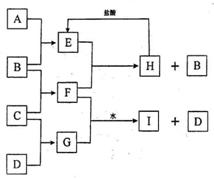 19.(9分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F含有电子总数为38,且焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
19.(9分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F含有电子总数为38,且焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
请填写下列空白:
(1)下列对F的叙述正确的是_________。
a. MgCl2的化学键类型与F完全相同
b. F与NH4H均为离子化合物
c. F的阴阳离子比与BaO2的相等
d. 因为F溶于水生成其它物质而具有导电性,所以F是非电解质
(2)E与F反应的化学方程式是______________________________。
(3)F与G的水溶液反应____________(填“属于”或“不属于”)基本反应类型。
20.(13分)X、Y、Z、W是原子序数依次增大的短周期主族元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是____________________(用元素符号表示)。
(2)X的符号为_________,Z的离子结构示意图为_________________。
(3)X与Y化学性质__________(填“相似”或“不相似”)。
(4)W的单质在常温下与NaOH溶液反应的离子方程式为_____________________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。
实验班期中考试化学试题 参考答案
单选题(3分×14=42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | B | A | B | D | C | C | C | D | D | D | D | B | B | A |
非选择题(共68分)
15.(10分)(1)负(或-2) (1分) F(或氟,或⑤)(1分)
(2)C(2分)
(3)①(甲为铝元素)(2分)
② 镁 (2分) b(2分)
16.(9分)(1)(H2O的形成过程) (3分)
(2)①三角锥形(2分)
②HCl H2S PH3 中的两种(或其它合理答案)(4分)
17. (13分)(1)第二周期ⅥA族 (2分)
(2)S2->O2->Na+(3分)
(3)SCl2、Cl2O (2分) 离子键和共价键(或非极性共价键)(2分)
(4)![]() =
=![]() (4分)
(4分)
18.(14分)(1)A (3分)
(2)ClO3-- + 5Cl-- + 6H+ = 3Cl2↑+ 3H2O (3分) 70.7(2分)
(3)酒精灯、石棉网(4分) 小于5.6(2分)
19.(9分)(1)b(3分)
(2)![]() =
=![]() (3分)
(3分)
(3)不属于(3分)
20.(13分)(1)Cl<S<Al(3分)
(2)Be(1分) (S2--的结构示意图)(1分)
(3)相似(1分)
(4)Cl2+2OH--=Cl-- + ClO-- + H2O(3分)
(5)3:5 (4分)
盐酸 盐酸 盐酸 水 水 水