高一化学(下)期末调研考试(选修)
化 学
(考试时间100分钟,全卷满分120分)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32
Cl-35.5 Br—80 Ag—108 Ba—137
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只是一个选项符合题意)
1.“保护环境,就是保护人类自己”。目前,在我国城市环境主要的大气污染物是
A.SO2、NO2、CO、烟尘 B.NH3、CO2、NO、雾
C.HCl、SO2、N2、粉尘 D. CO2、Cl2、N2、酸雨
2.下列物质中属于高分子化合物的是
A.蔗糖 B.聚氯乙烯 C.乙酸乙酯 D.C60
3.下列不属于配合物的是
A.[Cu(NH3)4]SO4·H2O B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O D.Na3[Al(OH) 6]
4.关于键能、键长和键角,下列说法不正确的是
A.键能的大小与原子形成共价键时放出的能量有关
B.键长的大小与成键原子的半径有关
C.键角的大小与键能、键长的大小无关
D.键能越大,键长越长,共价化合物越稳定
5.下列物质的电子式书写正确的是
![]() A.NaCl
A.NaCl ![]() B.H2S
B.H2S
C.-CH3 ![]() D.NH4I
D.NH4I 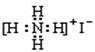
6.下列分子中,所有原子都满足最外层为8电子结构的是
A.CF2Cl2 B.PCl5 C.HCl D.BF3
7.在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117~125 kJ/mol的热量,但1,3-环己二烯(![]() )失去2个氢原子变成苯是放热反应,放出约23.4 kJ/mol的热量,此事实表明
)失去2个氢原子变成苯是放热反应,放出约23.4 kJ/mol的热量,此事实表明
A.1,3-环己二烯加氢是吸热反应
B.1,3-环己二烯比苯稳定
C.苯加氢生成环己烷是吸热反应
D.苯比1,3-环己二烯稳定
8.两种物质不论以何质量比混合,只要混合物的总质量一定,充分燃烧时产生水的量总为定值,这组混合物是
A.乙烷和乙烯 B.苯和苯乙烯 C.苯和甲苯 D.乙烷和丁烷
二、不定项选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得3分,但只要选错一个该小题就为0分)
9.下列关于丙烯(CH3—CH =CH2)的说法正确的
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
10.下列各组分子中的每个原子,或者处于同一平面,或者在一条直线上的是
A.C6H6,HCl,CH4 B.C2H6、HCl、C2H4
C.C6H6,C2H4,C2H2 D.CH4,HCl,H2C=CHCH3
11.下列是一些原子或离子的轨道表示式,其中合理的是
 |
12.下列说法中正确的是
A.C60气化和I2升华克服的作用不同
B.CH4和NH4+为等电子体,它们分子的空间结构相同
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
13.某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A.易溶于水,也易溶于有机溶剂
B.它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
C.它既能与溴发生加成反应,又能与溴发生取代反应
D.一定条件下,1mol该烃最多能与4mol H2发生反应
14.现有下列四个小实验,简要实验步骤及现象如下:①在紫色的KMnO4酸性稀溶液中,逐滴滴入过氧化氢溶液,溶液温度变化不大,但褪色速率越来越快;②将化学荧光棒[外层是塑料管放草酸二苯酯(还原剂)及发光颜料,内玻璃管中放入4%过氧化氢溶液]弯曲,内管断裂,液体混合,发出五颜六色的光;③两根外形相同的铁棒和锡棒紧靠,放入稀硫酸中,发现一根棒的表面有气泡产生;④正在烧煤球的煤炉中,滴上几滴水,立刻串出火苗。
下列分析正确的是
A.实验①中,反应生成的Mn2+可能是该反应的催化剂
B.实验②中,该反应是化学能转变为光能
C.实验③中,有气泡产生的棒是铁棒
D.实验④中,加入的水是反应的催化剂
15.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(气) + B(气) ![]() 2C(气) 。
2C(气) 。
若经2 s后测得C的浓度为0.6 mol•L-1。下列说法正确的是
A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7 mol•L-1
16.已知1mol N2和1molO2反应生成2 mol NO需要吸收180 kJ热量,其中N≡N、O=O键的键能分别为946 kJ·mol-1、498 kJ·mol-1,则N=O键的键能为
A.1264 kJ·mol-1 B.632 kJ·mol-1
C.316 kJ·mol-1 D.1624 kJ·mol-1
第Ⅱ卷(非选择题 共72分)
三、本题包括2小题,共20分
17.(10分)
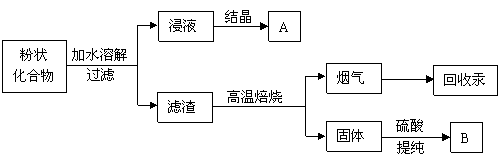 |
锌锰干电池广泛应用于生活、生产和科研。扔弃废干电池,不但造成资源浪费,还可造成严重环境污染。综合利用废干电池,除回收金属和碳棒外,对其内部的粉状化合物的处理过程如下:
试回答下列问题:
(1)锌锰干电池在使用过程中,负极发生的电极反应为__________________________。
(2)锌锰干电池内粉状化合物主要为MnO2 和NH4Cl糊。回收时得到的产品A的主要成分是_________、___________(填化学式),将其分离的方法是__________________。
(3)回收得到的产品B是MnSO4,在生产过程中一般需将其转化为重要的化工原料MnCO3。按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,你认为将MnSO4转化为MnCO3选用的反应物是_______________,得到的另一种最终产物的用途是_____________________________。
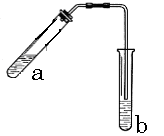 18.(10分)实验室可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请你参与研究:
18.(10分)实验室可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请你参与研究:
(1)实验时,试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入操作顺序是___________________________
___________________ 。
(2)试管a中发生反应的化学方程式为
________________________________________________。
(3)试管b中加有饱和Na2CO3溶液 ,其目的是
________________________________________________________________。
(4)若分离试管b中的混合物,需要用到的玻璃仪器是__________________。
(5)酯化反应进行得比较缓慢,用于提高该反应速率的主要措施是__________________________________________。
四、本题包括2小题,共16分.
19.(6分) 已知有关物质的熔沸点数据如下表:
|
| MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2982 | 1412 | 182.7 |
(1) 工业上常用电解熔融MgCl2的方法生产金属镁,而不用电解MgO的方法生产镁的原因是________________________________________________________。
(2) 电解Al2O3和冰晶石(Na3AlF6)熔融混合物的方法生产铝,该反应的化学方程式为
__________________________________,你认为冰晶石的作用是_________________。
(3) 钛(Ti)因具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应。在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,从所得的产物中获取金属钛的方法是_____________________________________。
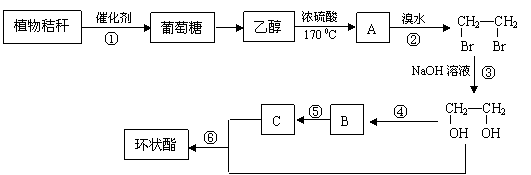 20.(8分) 随着现代工业的发展,能源问题已经越来越引起人们的重视。农民焚烧植物秸秆(主要成分是纤维素),不仅污染环境,也是资源的浪费。工业上利用植物秸秆为原料合成有机物环状酯。
20.(8分) 随着现代工业的发展,能源问题已经越来越引起人们的重视。农民焚烧植物秸秆(主要成分是纤维素),不仅污染环境,也是资源的浪费。工业上利用植物秸秆为原料合成有机物环状酯。
(1)在反应①~⑥中,属于取代反应的是___________________(填序号)。
(2) 反应①和②的化学方程式分别为
①____________________________________;②_______________________________。
(3)环状酯的化学式为C4H4O4,其结构简式为_______________________。
五、本题包括2小题,共18分
21.(8分)下列物质:HCl、HF、H2O、NH3、CO2、CaO、Na2O2、H2、Br2、NaF、CH4、CCl4、MgCl2、NH4Cl。
(1)上述物质中,含有非极性共价键的是_____________;属于非极性分子的化合物是_____________________。
(2) Br2(液溴)在CCl4 中的溶解度比在水中大的原因是
______________________________。
(3) N、O、F三种元素的原子形成 NH3、H2O、HF微观过程说明,氢化物分子中H原子数与其对应的基态原子中的未成对电子数有关,则你对基态C原子形成CH4分子的微观过程的合理猜想是__________________________________________________。
| I1 | I2 | I3 | I4 | |
| D | 500 | 4600 | 6900 | 9500 |
| E | 580 | 1800 | 2700 | 11600 |
22.(10分)已知A、B、C、D、E、F六种短周期元素原子序数依次增大。A、B、C三种元素位于同一周期,且其中A原子基态时电子排布式为1s22s22p2;A、C原子最外层具有相同数目的未成对电子;D是所在周期中电负性最小的元素,D、E两种元素的电离能数据(单位:kJ/mol)如右表;C、F两种元素原子核内的质子数与中子数相等,形成FC2型化合物,其中C与F的质量比为1∶1。
回答下列问题:
(1) AC2是大气中的温室气体,写出AC2分子的结构式_____________________。
(2) 依据VSEPR模型预测B的氢化物的立体结构为 ,中心原子B的轨道杂化类型为 。
(3) E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的化学方程式是 。
(4) F元素有两种含氧酸,其中酸性比较强的是______________,该酸酸性强于另一种含氧酸的原因是__________________________________________________________。
六、本题包括2小题,共18分
23.(10分)卤素互化物是指不同卤素原子之间通过共用电子对形成的化合物,其通式为XYn(n=1、3、5、7,且非金属性:X<Y)。卤素互化物大多为强氧化剂。试回答下列问题:
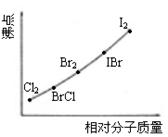 (1)若n=7,则最有可能生成卤素互化物应是_______________(写分子式)。
(1)若n=7,则最有可能生成卤素互化物应是_______________(写分子式)。
(2) XY型卤素互化物与卤素单质结构相似。依据右图,推测ICl的沸点所处的最小范围为
_____________________________。
(3)某卤素互化物与水的反应为:ClFn+H2O → HClO3 +Cl2↑+O2 ↑+HF,若ClFn与H2O 的物质的量之比为3∶5,则n=___________。
(4)现将18.65 g XYn溶于水,再通入过量SO2,生成HX、HY、H2SO4等三种酸,然后向该混合酸溶液中加入过量Ba(NO3)2 溶液后,过滤,最后向滤液中加入过量的AgNO3 溶液,结果生成61.85 g 沉淀,且溶液中除NO3- 外,无其它酸根离子。则混合酸溶液中HX与HY 两种酸的物质的量之和为_____________mol,该卤素互化物的化学式为___________________。
24.(8分) 甲烷是最简单的有机物。现有甲烷和空气的混合气体2400 mL(折算为标准状况,下同),一定条件下点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600 g,经检验剩余气体中还含有少量氧气。试计算:
(1)原混和气体中甲烷的体积分数。
(2)碱石灰吸收后剩余气体的体积。
化学参考答案及评分建议
1.A 2.B 3.C 4.D 5.C 6.A 7.D 8.B
9.AC 10.C 11.D 12.B 13.CD 14.AB 15.AD 16.B
17.(1)Zn-2e-=Zn2+ (2)NH4Cl 和 ZnCl2 加热
(3)(NH4)2CO3 (NH4)2SO4 用作化肥
(每空2分,本题共10分,其它合理答案参照给分)
18.(1) 先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸
(2) CH3COOH
+ C2H5OH![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
(3) 吸收随乙酸乙酯蒸出的少量酸性物质和乙醇
(4)分液漏斗、烧杯(玻璃棒)
(5)加热、使用浓硫酸作催化剂或增大乙醇的浓度 (每空2分,本题共10分)
19.(1) MgCl2和MgO在熔化状态下都能电离,但MgO的熔点太高,耗能多
(2) 2Al2O3 (熔融) 4Al + 3O2↑ 降低Al2O3 的熔点
(3) 加入足量盐酸,除去过量金属镁,过滤并用蒸馏水洗涤固体即得金属钛
(每空2分,本题共8分)
 |
![]()
![]() 20.(1)③⑥
(3)
20.(1)③⑥
(3)
![]() (2)(C6H10O5)n
+n H2O n C6H12O6 CH2==CH2
+ Br2
(2)(C6H10O5)n
+n H2O n C6H12O6 CH2==CH2
+ Br2
纤维素 葡萄糖
(每空2分,本题共8分)
21.(1) H2、Br2、Na2O2 CO2、CH4、CCl4
(2)溴单质是非极性分子,CCl4 是非极性溶剂,相似相溶
(3)基态C原子有1个2s电子激发到p轨道,形成4个未成对电子
(每2分,本题共8分)
22.(1) O=C=O (2分) (2) 三角锥形 sp3 (2分)
(3) Al(OH)3+NaOH=NaAlO2+2H2O (3分)
(4) H2SO4 (1分) H2SO4中S的化合价为+6价,比H2SO3高,S的正电性越高,导致S—O—H中O的电子偏向S,在水分子的作用下,越容易电离出H+ (2分)
(本题共10分)
23.(1)IF7 (2) 介于Br2的沸点和IBr的沸点之间 (3) 3 (4) 0.4 BrCl3
(每空2分,本题共10分)
![]() 24.(1) CH4
+2O2 CO2 +2H2O
24.(1) CH4
+2O2 CO2 +2H2O
n(CH4)=n(CO2 )= 0.600 g×××mol/g=0.00750 mol (2分)
原混和气体中甲烷的体积分数为
×100%=7.00% (2分 )
(2) n(O2)=2 n(CH4)=0.0150 mol (2分)
反应后剩余气体体积为
2400 mL-(0.00750 mol+0.0150 mol)×22400 mL/mol =1896 mL (2分)
(本题共8分,其它合理答案参照给分)