高一化学10月月考测试题
第І卷
一、选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1.下面有关氧化还原反应的叙述正确的是 ( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只作氧化剂
D.某元素从化合态变成游离态时,该元素一定被还原
2.下列四个有水参加的化学反应中,水只作还原剂的是 ( )
A.电解水 B.铁和水蒸气作用生成四氧化三铁和氢气
C.氟气和水作用 D.氯气和水反应
3.在反应8NH3 + 3Cl2== 6NH4Cl + N2中, 若有2molNH3被氧化,则 ( )
A.生成1molN2 B.有4molNH3 参加反应
C.3 mol氯原子被还原 D.3molCl2被氧化
4.下列物质的保存方法不正确的是
( )
A.新制氯水应密封保存 B.盛液溴的试剂瓶常加少量水
C.少量的金属钠应保存在煤油中 D.固态碘放在棕色细口瓶中
5.下列叙述中可说明酸甲比酸乙酸性强的是 ( )
A. 溶液导电性酸甲大于酸乙 B. 酸甲是二元酸,而酸乙是一元酸
C. 酸甲能与乙的钠盐反应生成酸乙 D. 酸甲的电离不完全,而酸乙能全部电离成离子
6.下列物质用途错误的是 ( )
A.溴化银可用于制胶片和有色玻璃 B.过氧化钠可用于漂白织物、羽毛等
C.碘化银可用于人工降雨 D.![]() 可以用于配制含碘食盐
可以用于配制含碘食盐
7.下列离子方程式书写正确的是 ( )
A.二氧化碳通入过量的氢氧化钠溶液:CO2 +2OH- =CO32- +H2O
B.碳酸钙与硝酸反应:CO32- +2H+ =H2O +CO2↑
C.碳酸钠溶液中通人CO2气体 :CO32-+CO2 +H2O=2 HCO3-
D.碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2+ +HCO3- +OH-= CaCO3↓++ H2O
8.下列各物质按所含原子数由大到小顺序排列的是 ( )
①0.3molNH3 ②标准状况下的22.4L氯气 ③9mLH2O(4℃) ④0.2mol磷酸
A.①④③② B.④③②① C.②④③① D.①④②③
9.核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的( )
A.![]() mol B.
mol B.![]() mol
mol
C.(A-N+2)mol D.![]() mol
mol
10.自然界中钙元素有两种天然同位素:![]() Ca和
Ca和![]() Ca,已知钙元素的近似相对原子质量为
Ca,已知钙元素的近似相对原子质量为
40.08,则![]() Ca和
Ca和![]() Ca的原子个数比是 ( )
Ca的原子个数比是 ( )
A.12:1 B.24:1 C.1:12 D.1:24
11.X和Y是原子序数大于4的短周期元素,![]() 、
、![]() 两种离子的核外电子排布相同。下列说法中正确的是 ( )
两种离子的核外电子排布相同。下列说法中正确的是 ( )
A.X的原子半径比Y的原子半径小 B.X和Y的核电荷数之差为m -- n
C.Y原子核内所含质子数比X多 D.![]() 半径比
半径比![]() 小
小
12.对Na Mg Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3 B.原子半经:Na<Mg<Al
C.离子的氧化性:Na+>Mg2+>Al3+ D.单质的还原性:Na<Mg<Al
13.美国“9.11”恐怖袭击事件中,毁坏的建筑物散发出大量石棉,人吸入石棉纤维易患肺癌。
石棉是硅酸盐矿物,某种石棉的化学式表示为:![]() ,该化学式中x, y
,该化学式中x, y
的值分别是 ( )
A.5、8 B.8、3 C.3、8 D.8、5
14.某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键 ( )
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.上述说法都不正确
15.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质 ( )
A.钋是能导电的固体 B.钋的氧化物的水化物至少有两种
C.钋与氢气不能直接化合生成气态氢化物 D.钋的氢化物很稳定
16、下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Ag+、![]() 、Cl-
B.Ba2+、
、Cl-
B.Ba2+、![]() 、CO32-、OH-
、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3- D.Al3+、Fe3+、SO42-、Cl-
17.下列实验现象描述正确的是 ( )
A.红热的铜丝在氯气中燃烧,产生棕色的烟
B.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫色
C.往溴水中加入碘化钠溶液,溴水变为无色
D.氢气在Cl2中燃烧产生白色的烟
18.F2是氧化性最强的非金属单质,在加热条件下,物质的量相等的F2跟烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的 ( )
A.H2 B.HF C.OF2 D.O2
19.下列事实,不能说明氯元素的非金属性比硫元素强的是 ( )
A.氯气与H2S能发生置换反应 B.HClO4酸性比H2SO4强
C.盐酸是强酸,氢硫酸是弱酸 D.受热时,氯化氢比硫化氢稳定
20.化合物A、B、C都只含两种元素,且A、B均含X元素,已知在一定条件下可发生反应 A+B→X+C,X是一种单质,由此可知X元素 ( )
A.一定是金属元素 B.一定是非金属元素
C.可能是金属元素 D.可能是非金属元素
第ІІ卷
二、填空
21.(7分)(1)工业上制造普通玻璃的主要原料是 ___、 ___ 、_________,
主要原料熔化后,发生的主要化学反应是:
(2)____________________________________________;
22.(8分)现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体
⑥纯蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化的KNO3,请回答下列问题(用序号):
⑴以上物质中能导电的是________________。
⑵以上物质中属于电解质的是__________________。
⑶以上物质中属于非电解质的是__________________。
⑷以上物质中溶于水后形成的水溶液能导电的是___________________。
23.(6分)溴化碘(IBr)的化学性质类似于卤族单质,试回答下列问题:
(1)IBr的电子式_____________,IBr属 ______化合物。(填“离子”或“共价”,下同)
(2)溴化碘和金属镁反应生成物属于_______化合物,生成物之一的电子式 。
(3)溴化碘和水反应生成一种三原子分子,该分子的电子式为__________,其分子中化学键类型为___________。
24.(8分)为了验证浓H2SO4和木炭在加热时发生反应生成水、二氧化碳和二氧化硫。为确认各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)
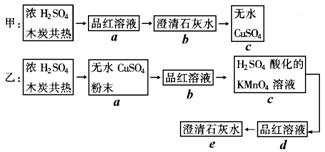
(1)上述甲、乙两方案中可达到实验目的的是______________(填“甲”或“乙”)。
(2)简述方案不可行的理由__________________________________________________
(3)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:_____________________________________________________________________
25.(12分)1-18号元素A、B、C、D中,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.4gA的氧化物恰好与100mL 0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等。B元素原子核外M层比K层多1个电子。C得到一个电子后电子层结构达到稳定结构,其最高价氧化物的水化物为自然界最强的酸。D元素原子核外L层比K层多2个电子。
(1)写出A、B、C、D四种元素的符号:
A_______、B_______、C_______ 、D_______
(2)C的离子结构示意图为________;D的原子结构示意图为_______
(3)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35ml浓度为1mol/L的苛性钠溶液现象是__________________________________,离子反应方程式为___________________________________。
将生成物过滤、洗涤、干燥灼烧,可得白色固体质量为 。
26.(7分)超重元素的假设预言自然界中可能存在114号的稳定同位素X,请根据原子构
理论和元素周期律预测:
(1)X元素位于周期表中第_______周期,________族,为_______元素(金属或非金属)
(2)写出其最高价氧化物及其水化物的化学式_______________、_____________,并估
计后者为_____________(酸性或碱性)
(3)它与氯气反应生成的化合物的化学式为_________________。
三、计算题:(12分每小题6分)
27.(7分)密闭容器中将3.62 gNaOH、Na2S、Na2SO3的混合物溶于50 mL某浓度的稀 H2SO4
中,不放出任何气体,再加入100 mL 0.1mol·L-1的Ba(OH)2溶液,正好中和过量的
H2SO4。将反应所得沉淀分离、洗净、烘干、称重,其质量为3.29 g 。求:
(1)原混合物中各物质的物质的量之比;
(2)原稀H2SO4的物质的量浓度。
28.(8分)现有等物质的量的NaHCO3和KHCO3的混合物a(g)与100mL盐酸反应.题中涉及的气体体积均为标准状况下,填空时可以用带字母的分式表示.
(1)该混合物中NaHCO3与KHCO3的质量比为____________.
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为___________mol·L-1.
(3)如盐酸过量,生成CO2的体积为_____________L
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还须知道______________,说明原因: ___________________________
高一化学10月月考试题答题卡
一、选择题(本题共20小题,每小题3分共60分,每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
二、空题(本题共小题,共40分)
21.(10分)
(1)( ) ( ) ( )
(2)( )( )
22.(8分)
(1)( ) (2)( )
(3)( ) (4)( )
23.(6分)
(1)( )
(2)( )
(3)( )
24.(7分)
(1)( )
(2)(
)
(3)( )
25、(12分)
(1)( ) ( ) ( ) ( )
(2)( ) ( )
(3)( )
( ) ( )
26、(7分)
(1)( )( ) ( )
(2)( ) ( ) ( )
(3)( )
三、计算题(本题共2小题,第1小题8分第2小题12分,共12分)
27.
| |
28.
高一化学10月月考试题答题卡
一、选择题(本题共20小题,每小题3分共60分,每小题只有一个选项题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | A | D | C | D | C | C | C | B | D | A | A | C | D | D | A | C | C | B |
二、空题(本题共小题,共40分)
21.(7分)
(1)(纯碱 ) ( 石灰石 ) ( 石英 )
(2)(  )
)
22.(8分)
(1)(④⑧ ) (2)( ①③⑤⑧ )
(3)(②⑥⑦ ) (4)( ①②③⑧)
23.(6分)
(1)( ![]() ) ( 共价 )
) ( 共价 )
(2)( 离子 )( ![]() )
)
(3)(![]() ) (共价)
) (共价)
24.(8分)
(1)( 乙 )
(2)(甲方案不可行的理由是:用品红溶液检验生成的二氧化硫时,吸收二氧化硫可能不充分,影响二氧化碳气体的检验;同时气体通过品红溶液和澄清石灰水时,也会打出水汽,影响对生成物中水的检验。 )
(3)A.验证反应生成的水 B.验证产生的SO2 C.除SO2气体 D.检验SO2否除尽e验证产生的CO2 25、(12分)
(1)(A:Mg ) ( B:Al ) ( C:Cl ) ( ;D:C )
(2)( ) ( )
(3)(现象是产生白色沉淀,后沉淀部分溶解 。 ) (化学反应方程式为 AlCl3+3NaOH=Al(OH)3+3NaCl,Al(OH)3+NaOH==NaAlO2+2H2O ) ( 质量为0.255g )
26、(7分)
(1)(七) ( IVA族) (金属)
(2)( XO2、 ) ( X(OH)4 ) ( 碱性 )
(3)( X+2Cl2==XCl4 )
三、计算题(本题共2小题,第1小题8分第2小题12分,共12分)
27.解:(1)2Na2S+Na2SO3+3H2SO4==3S↓+3Na2SO4+3H2O,
H2SO4+Ba(OH)2==BaSO4↓+3H2O,由题意知:(Na2S) : Na2SO3=2:1
设NaOH为y, Na2S为2x ,Na2SO3为x有:
![]()
∴NaOH:Na2S:Na2SO3=0.020 : 0.02 : 0.01=2 : 2 : 1 (2')
(2)SO42-守恒,最终溶液中为BaSO4:2.33g为0.1mol
Na元素守恒:NaOH:0.02mol, Na2S:0.02mol , Na2SO3 :0.01mol
∴n(Na)=0.02+0.02×2+0.01×2=0.08mol (2')
∴n(Na2SO4)=0.04mol, ∴C(H2SO4)= ![]() = 0.8mol/L (1') 答:略。
= 0.8mol/L (1') 答:略。
| |
含KHCO3为(a—x)g.
则![]()
即m(NaHCO3):m(KHCO3)=84:100 (2分)
(2)设盐酸物质的量浓度为z(mo1·L-1),则
NaHCO3
+ HCl NaCl +
H2O + CO2↑
84g 1mol
![]()
![]()
![]()
(3)设盐酸过量时生成CO2的体积为V(L),则:
NaHCO3
+ HCl
NaCl + H2O + CO2↑
84g 22.4L
![]()
![]()
![]()
(4)盐酸的物质的量浓度;如果盐酸不足量,则应该以HCl的量为计算标准,这就须知 道盐酸物质的量浓度.(各2分)