高一化学上册期中试卷
可能用到的原子量:H-1 Cl-35.5 N-14
一、选择题(每小题只有一个答案,每小题2分,40%)
1.根据下列物质中S元素的化合价判断,下列说法错误的是
A.H2SO4具有氧化性 B.H2SO4具有还原性
C.H2S具有还原性 D.SO2既有氧化性又有还原性
2.下列反应中,是氧化还原反应的是
①SiO2+CaO![]() CaSiO3 ②2KClO3
CaSiO3 ②2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
③NH4Cl![]() NH3↑+HCl↑
④2Cu+S
NH3↑+HCl↑
④2Cu+S![]() Cu2S
Cu2S
⑤Zn+2 HCl=== ZnCl2+H2↑ ⑥C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
A、①③④⑤ B、③④⑤⑥ C、①②④⑤ D、②④⑤⑥
3.下列各反应中,二价铁被还原的是
A.2Fe2++Br2====2 Fe3++2Br- B.2FeCl2 +Cl2 ==== 2FeCl3
C.2FeO+Si ![]() 2Fe +
SiO2 D.FeO+2 H+==== Fe2++ H2O
2Fe +
SiO2 D.FeO+2 H+==== Fe2++ H2O
4.下列变化过程需加入氧化剂的是
①HCl→Cl2 ②HCl→H2 ③Mn2+→MnO4― ④Fe3O4→Fe
A、错误!未找到引用源。错误!未找到引用源。 B、错误!未找到引用源。错误!未找到引用源。 C、错误!未找到引用源。错误!未找到引用源。 D、错误!未找到引用源。错误!未找到引用源。
5.下列物质不能作为还原剂的是
A、H2S B、Fe2+ C、Fe3+ D、SO2
6.下列说法中,正确的是
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
7.在黑火药燃烧的反应2 KNO3+S+3C ===K2S+N2↑+3CO2↑中,被氧化的元素是
A、S B、C C、N D、O
8.下表中强电解质、弱电解质、非电解质的分类,正确的是
| A | B | C | D | |
| 强电解质 | NaOH | CuSO4 | BaSO4 | CH3COOH |
| 弱电解质 | NH3•H2O | CaCO3 | CH3COOH | 铝 |
| 非电解质 | 酒精 | 水银 | 水银 | CO2 |
9.下列关于强、弱电解质的叙述正确的是
A、强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质
B、所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D、SO2的水溶液能导电,所以SO2是电解质
10.下列离子方程式错误的是
A、硫酸与氢氧化钡溶液反应:H++OH-===H2O
B、硝酸与氢氧化钠溶液反应:H++OH-===H2O
C、氨水与醋酸溶液反应:
CH3COOH+NH3•H2O===H2O+CH3COO-+NH4+
D、Na2CO3溶液与盐酸反应:CO32-+2H+===H2O+CO2↑
11.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是
A、Cu2+、Cl-、K+、SO42- B、CO32-、Na+、K+、SO42-
C、Mg2+、Cl-、K+、NO3- D、Ag+、NO3-、K+、Cl-
12.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2+HCl;Cu(OH)2+CH3COOH
B.CaCO3+HCl;Na2CO3+HCl
C.AgNO3+HCl;AgNO3+NaCl
D.BaCl2+H2SO4;Ba(OH)2+H2SO4
13.氢氧化钡溶液中滴入硫酸溶液并测定溶液导电性,下面各图表示的是随着硫酸滴入量的变化溶液导电能力变化的图像,其图像表示正确的是(横坐标为硫酸滴入量,纵坐标为导电性)
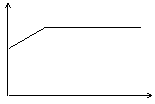
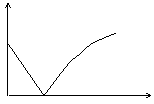 A B
A B
C D 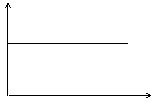
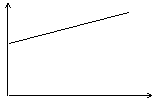
14.下列四种物质的溶液中,除水分子外,还存在其他分子的是
A、H2SO4 B、HCl C、CH3COOH D、Ba(OH)2
15.为了防止环境污染,下列燃料最理想的是
A、煤 B、石油 C、氢气 D、天然气
16.下列实验中显著吸热的是
A、铝片放入盐酸中反应 B、浓硫酸加入水中
C、甲烷在空气中燃烧 D、氢氧化钡晶体和NH4Cl晶体反应
17. 选用一种试剂能把浓度相同的NaOH、Na2CO3、BaCl2溶液加以区别,这种试剂是
A、硫酸 B、CuSO4溶液 C、NaCl溶液 D、AgNO3溶液
18.组成中具有相同原子团的一组物质是
A、KClO3和KClO B、MgCl2和BaCl2
C、NH4Cl和NH4HCO3 D、Na2SO4和NaNO3
19.同温同浓度条件下发生以下反应
错误!未找到引用源。 Cl2+2KI===2KCl+I2 错误!未找到引用源。2FeCl2+Cl2===2 FeCl3
错误!未找到引用源。2 FeCl3+2HI===2FeCl2+2HCl+I2 错误!未找到引用源。 I2+SO2+2H2O === H2SO4+2HI
由此判断氧化性由强到弱的顺序正确的是
A、Cl2>I2>Fe3+>SO2 B、Cl2>Fe3+>I2>SO2
C、Cl2>Fe3+>SO2>I2 D、Fe3+>Cl2>I2>SO2
20.下列有关氧化还原反应的叙述正确的是
A、 肯定有一种元素被氧化,另一种元素被还原
B、在反应中一定所有元素的化合价都发生变化
C、置换反应一定属于氧化还原反应
D、化合反应和分解反应中不可能有氧化还原反应
二、填空题(33%)
21.若反应物的总能量 生成物的总能量,则该反应是放热反应;若反应物的总能量 生成物的总能量,反应中反应物需要 ,则该反应是吸热反应。燃料燃烧必须与空气接触,且要达到燃料的着火点,燃料充分燃烧要考虑两点:一是 ;二是 。
22. 在2KMnO4 + 16HCl === 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O反应中, 氧化剂是 ;还原剂是 ; 元素被氧化; 元素被还原; 氧化产物是 ; 是还原产物;电子转移总数为 。
23. Cl2通入70℃的氢氧化钠水溶液中,发生氧化还原反应,化学方程式为:
7 Cl2+14 NaOH===9NaCl+NaClO3+4NaClO+7H2O此反应的离子方程式为
24 某溶液中可能有下列离子:SO42-、NO3-、Cl-、CO32-、OH-,试判断:
(1) 当溶液中有大量H+时,溶液中不能大量存在的离子是
(2) 当溶液中有大量Ba2+时,溶液中不能大量存在的离子是
(3) 当溶液中有大量Ag+时,溶液中不能大量存在的离子是
(4)溶液中有大量 和 离子时,溶液中只能大量存在NO3-。
25.现有下列反应: ①3H2+Fe2O3![]() 2 Fe+3H2O
2 Fe+3H2O
②F当e+CuSO4=== Cu+FeSO4
③Ba(OH)2+H2SO4=== BaSO4↓+2H2O
④NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(1) 有元素化合价升降的反应是(用序号填空)
(2) 既属于置换反应又属于氧化还原反应的是(用序号填空)
(3) 对氧化还原反应用“双线桥”表示电子转移数目和方向,指明氧化剂和还原剂。
三、实验题(17%)
26.有一包固体,可能含有BaCl2、CuCl2、Na2CO3的混合物中若干种。将此固体溶于水时,有白色沉淀生成。过滤后,滤液为无色。若沉淀加入稀盐酸。有气体生成,将气体通入澄清石灰水中,石灰水变浑浊。若在滤液中滴入AgNO3溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解。根据上述现象推断,该固体含有的物质是 。写出有关的离子方程式:
27.除去下列物质中的杂质(括号内),写出选用的试剂及反应的离子方程式。
错误!未找到引用源。 NaOH (Na2SO4) ,
错误!未找到引用源。 Na2CO3(NaOH) ,
错误!未找到引用源。CaCl2(CaCO3) ,
四、计算题(10%)
28.把Cl2通入氨水中发生如下反应:8NH3+3Cl2 === N2↑+6NH4Cl,当逸出的气体中含有0.28g N2时,问:
① 参加反应的氨的质量是多少克?②反应中被氧化的氨的质量是多少克?
高一化学答案
一、选择题(40%)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | C | A | C | B | B | A | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | C | A | C | C | D | A | C | B | C |
二、填空题(33%)
21、大于,小于,吸收热量。适当过量的空气;与空气有足够大的接触面。
22、KMnO4;HCl;Cl;Mn;Cl2;MnCl2;10e-。
23、7 Cl2+14OH-===9Cl-+ClO3-+4 ClO-+7 H2O
24、(1)CO32-、OH- (2)CO32-、SO42-
(3)CO32-、OH-、SO42- 、Cl- (4)Ba2+、Ag+
25、(1)①② (2)①②
(3)
 得到6e-
失去2e-
得到6e-
失去2e-
Fe2O3+3H2![]() 2Fe+3H2O Fe+CuSO4=== FeSO4+Cu
2Fe+3H2O Fe+CuSO4=== FeSO4+Cu
失去6e- 得到2e-
氧化剂 还原剂 还原剂 氧化剂
三、实验题(17%)
26、BaCl2、Na2CO3
Ba2++CO32-=== BaCO3↓ BaCO3+2H+=== Ba2++CO2↑+H2O
Ca2++2OH-+CO2=== CaCO3↓+H2O Ag++Cl-=== AgCl↓
27、(1)Ba(OH)2 Ba2++SO42-=== BaSO4↓
(2)适量CO2 2OH-+CO2=== CO32-+H2O
(3)盐酸 CaCO3+2H+=== Ca2++CO2↑+H2O
四.计算题(10%)
28、①8NH3+3Cl2 === N2+6NH4Cl
8×17 28
x 0.28g
x=1.36g
②2/8×13.6=0.34g