高一年级化学第一学期期末考试试题
化学试题
(满分:100分 考试时间:90分钟)
可能用到的相对原子质量:H 1 O 16 Cl 35.5 Cu 64 Zn 65
一、选择题(每题只有一个正确选项符合题意,每题2分,共20分)
1、硅被誉为无机非金属材料的主角。制造下列器件须用到硅单质的是( )
A、陶瓷餐具 B、石英钟表 C、计算机芯片 D、光导纤维
2、下列物质中,不属于电解质的是( )
A、NaOH B、H2SO4 C、蔗糖 D、NaCl
3、等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A、NaOH B、H2SO4 C、蔗糖 D、NaCl
4、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止溶液倒吸的是
5、下列物质充分加热分解后,没有固体物质残留的是( )
A、NaHCO3 B、NH4HCO3 C、 KClO3 D、 CaCO3
6、下列反应不属于氧化还原反应的是( )
A、石灰石固体煅烧 B、铝片投入氢氧化钠溶液中
C、氢气和氧气混合点燃 D、氢气通入盛灼热氧化铜的试管
7、下列两种离子在溶液中能够大量共存的是( )
A、Mg2+ 和SO42- B、CO32- 和H+ C、Fe3+ 和OH- D、H+ 和OH-
8、下列事实,不会造成空气污染的是( )
A、随意焚烧垃圾 B、使用含磷洗衣粉
C、汽车排放的尾气 D、用煤和石油产品作燃料
9、下列氧化物中不与水反应的是( )
A、CO2 B、CaO C、SiO2 D、Na2O2
10、下列离子方程式中,书写正确的是( )
A、铁和稀硫酸反应:2Fe+ 6H+=== 2Fe3++3 H2↑
B、碳酸钙和稀盐酸反应:CO32-+2H+===CO2↑+ H2O
C、铜和硝酸银溶液反应: Cu+Ag+===Cu2++Ag
D、硫酸镁溶液与氢氧化钠反应:Mg2++ 2OH-=== Mg(OH)2↓
二、选择题(每题只有一个正确选项符合题意,每题3分,共24分)
11、下列说法错误的是( )
A、纯碱不是碱,溶液显碱性 B、王水不是水,可以溶解金
C、干冰不是冰,常作致冷剂 D、醋酸不是酸,能被碱中和
12、近年来我国不少地区多次出现大雾天气,致使高速公路关闭,航班停飞。从物质分类角度来看,雾属于下列分散系中的( )
A、溶液 B、悬浊液 C、乳浊液 D、胶体
13、下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
A、MgO B、Al(OH)3 C、SiO2 D、AlCl3
14、下列反应中,因为反应条件改变,反应产物可以不同的是( )
A、钠与氧气反应 B、稀盐酸和硝酸银溶液
C、铁在氯气中燃烧 D、一氧化碳在氧气中燃烧
15、用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、32g氧气所含原子数目为2NA
B、氯化氢的摩尔质量为36.5g
C、在常温常压下,11.2L氯气含有的分子数为0.5NA
D、在标准状况下,22.4L水的物质的量是1mol
16、如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是( )
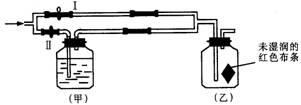
A、浓H2SO4 B、NaOH溶液 C、Ca(OH)2溶液 D、NaCl溶液
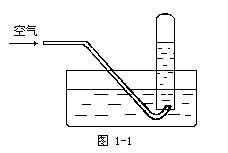 17、按图1-1进行实验,试管内充满NO,然后间歇而缓慢地通入一定体积O2,下面有关实验最终状态的描述不正确的是( )
17、按图1-1进行实验,试管内充满NO,然后间歇而缓慢地通入一定体积O2,下面有关实验最终状态的描述不正确的是( )
A、若最终有气体剩余,气体呈红棕色
B、若最终有气体剩余,气体是NO
C、试管内溶液为稀的硝酸溶液
D、试管内的液面高度肯定会上升
18、已知:Ba(OH)2(aq)与Ca(OH)2(aq)性质相似,且Ca(OH)2(aq)![]() 溶液澄清。现在
溶液澄清。现在
一定体积的某溶液中不断通入CO2,溶液的导电性(I)随通入CO2物质的量[n(CO2)]的变化曲线如
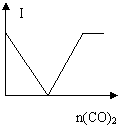 图所示,则此溶液可能是( )
图所示,则此溶液可能是( )
A、NaOH(aq) B、CaCl2(aq)
C、Na2CO3(aq) D、Ba(OH)2(aq)
三、填空题(本题共21分)
1、(7分)化学对人类社会进步和发展的贡献之一是研制和发现了各种材料,例如金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
(1)、铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是 。
A、铜的熔点不是太高,易于冶炼,铸造成型 B、铜的性质不活泼,不易被腐蚀
C、我国较早的掌握了湿法冶炼铜的技术 D、自然界有大量的游离态的铜
(2)、钢铁制品使用更为广泛,但是铁制品易生锈,铁锈的主要成分是 (填名称),铁的氧化物常见的还有 、 (填化学式)。
(3)、铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为 。
2、(14分)无机化合物可根据其组成和性质进行分类,
 |
(1)上图所示的物质分类方法名称是 。
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧SO3 | ⑨NH3 |
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在上表中②、④、⑥后面。
(3)写出⑦转化为⑧的化学方程式 。
(4)写出Cu与①的浓溶液反应的化学方程式 ,
该反应中氧化剂是 。
(5)实验室制备⑨常用 和 反应,检验该气体的方法是 。
四、推断题(10分)
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
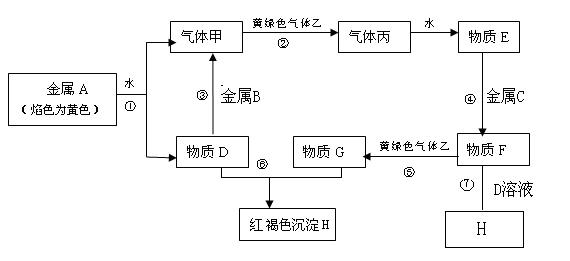
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、F 。
(2)说出黄绿色气体乙的一种用途 。
(3)区别E、F两种溶液最简单的方法是 ,实验室检验G中所含的金属离子时,常在G的溶液中加入 溶液。
(4)反应①的离子方程式为 。
(5)反应⑦的化学方程式为 。
五、实验题(13分)
利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等。
(一)、从海水得到的粗食盐水常含![]() 、
、![]() 、
、![]() ,需要分离提纯。现有含少量
,需要分离提纯。现有含少量![]() 、
、![]() 的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②
的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②![]() 、③
、③![]() 、④
、④![]() 来除去食盐水中的
来除去食盐水中的![]() 、
、![]() 、
、![]() 。提纯时的操作步骤和加入试剂的情况如下图。
。提纯时的操作步骤和加入试剂的情况如下图。
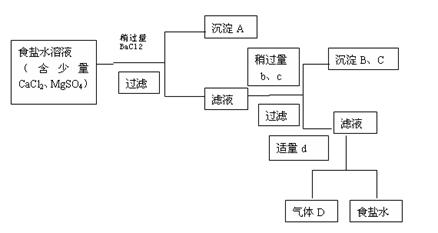
图中a、b、c、d分别表示上述4种试剂中的各一种,试回答:
(1)沉淀A的名称是 ;
(2)试剂d是 ;判断试剂d已经足量的方法是 ;
(3)加入b、c后溶液中发生的化学反应的离子方程式为 ;
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到 (填字母),仪器A的名称是 。
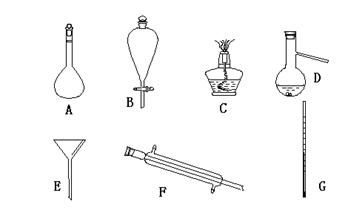
(二)、海水蒸馏是由海水获得淡水的常用方法之一,在实验室组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器由下向上,从左到右的顺序,这些仪器依次是 (填字母)。
(三)、海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填字母),该仪器名称为 ,向该碘水中加入四氯化碳以提取碘单质的实验操作称为 。
六、计算题(12分)
实验室常用的浓盐酸密度为1.17g.mL-1、质量分数为36.5%。
(1)、此浓盐酸的物质的量浓度为 。
(2)、取此浓盐酸50mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 。
(3)将13g锌投入足量的上述实验所得的稀盐酸中,充分反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过足量的灼热CuO,求被还原出的铜的质量。(假设氢气在反应中没有损失)
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | C | C | B | A | C | B | C | D |
二、
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | D | B | A | C | D | A | A |
三、
1、(1)A、B、C。(2)氧化铁,FeO、Fe3O4。(3)Al2O3+2NaOH==2NaAlO2+H2O。
2、(1)树状分类法。(2)②HNO3④KOH⑥Na2SO3。(合理答案均可给分)
(3)2SO2+O2![]() 2SO3
2SO3
(4)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,H2SO4。
CuSO4+SO2↑+2H2O,H2SO4。
(5)氯化铵、氢氧化钙,用湿润的红色石蕊试纸检验,试纸变蓝色。
四、
(1)Na 、FeCl2。(2)自来水消毒或制造盐酸(合理答案均可给分)。
(3)观察两种溶液颜色,硫氰化钾溶液或氢氧化钠溶液。
(4)2Na+2H2O==2Na++2OH-+H2↑
(5)4Fe(OH)2+O2+2H2O==4Fe(OH)3
五、
(一)
(1)硫酸钡。(2)盐酸,溶液中不再产生气体。
(3)Ca2++CO32-==CaCO3↓、Ba2++CO32-==BaCO3↓、Mg2++2OH-==Mg(OH)2↓
(4)E,容量瓶。
(二)C、D、G、F
(三)B,分液漏斗,萃取。
六、(1)11.7 mol/L。(2)2.52 mol/L。(3)①4.48L,②12.8 g。