高一年级化学第二学期中测试试题
化学(非化学专业)试卷
命题人 :瞿 军 校题人:郑春荣 审题人: 翟新民
时间:75分钟 满分100分
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ba 137 Cl 35.5
第 一 卷(选择题 共69分)
一、选择题(本题包括23小题,每小题3分,共69分。每小题只有一个选项符合题意)
1.有关化学用语正确的是
A.氯乙烷的分子式C2H5 Cl B.乙醇的结构简式C2H6O
![]() C.四氯化碳的电子式Cl∶C∶Cl D. 乙烯的结构简式CH2 CH2
C.四氯化碳的电子式Cl∶C∶Cl D. 乙烯的结构简式CH2 CH2
2.下列哪一个分子模型不属于比例模型:
A.苯分子 B.乙醇分子
B.乙醇分子
![]() C.甲烷分子
C.甲烷分子![]() D.乙烯分子
D.乙烯分子![]()
3.下列相关结论不正确的是
A.降低温度能减小化学反应速率 B.催化剂能加快化学反应速率
C.反应物浓度越小,化学反应速率越快
D.反应物之间接触面积越大,化学反应速率越快
4.为了使江苏的天更蓝,空气更清新,目前南京市对没有申领到“绿色”通行证的高污染车实
行限行。高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还
主要含有
 A.二氧化碳 B.氮氧化物 C.水蒸汽
D.氮气
A.二氧化碳 B.氮氧化物 C.水蒸汽
D.氮气
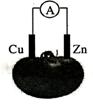
5.实验要知其所以然。将铜片和锌片用导线连接后插入番茄里,如下图所示, 电流计指针发生偏转,锌片是
A.电子流入的一极 B.正极
C.发生还原反应的一极 D.负极
6.据有关资料称:直接从自然界获得的能源为一级能源,如流水、风力、原 油、石油、天然气、天然铀矿等;一级能源经过加工、转换得到的能源为二级能源,如电力、蒸汽等。有专家指出,如果将燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合变成CH4、CH3OH、NH3等的构想能够成为现实,则下列说法中,错误的是
A.可消除对大气的污染 B.可节约燃料
C.可缓解能源危机 D.此题中的CH4、CH3OH、NH3等为一级能源
7.NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此
反应,下列叙述正确的是
A.使用适当的催化剂不改变反应速率 B.降低压强能提高反应速率
C.升高温度能提高反应速率 D.改变压强对反应速率无影响
8.向一定量的下列物质的溶液中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解.
这种物质是
A.MgS04 B.NaAl02 C.A1C13 D.FeCl3
9.符合下列分子式的有机物没有同分异构现象的是
A.CH4 B.C4H8 C.C4H10 D.C5H12
10.实验室欲快速制取氢气,应采取的措施是
A .纯锌和稀硫酸反应 B.含铜、铅等杂质的粗锌和稀硫酸反应
C.纯锌和浓硫酸反应 D.粗锌和稀硝酸反应
11.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
12.葡萄糖作为营养剂供给人体能量,一部分葡萄糖在体内最终生成CO2和H2O的反应是
A.氧化反应 B.取代反应 C.加成反应 D.聚合反应
13.下述关于烃的说法中,正确的是
A.烃是指仅含有碳和氢两种元素的有机物
B.烃是指分子里含碳元素的化合物
C.烃是指燃烧反应后生成二氧化碳和水的有机物
D.烃是指含有碳和氢元素的化合物
14.下列环保措施主要目的是保护臭氧层的是
A.使用无铅汽油 B.使用可降解塑料
C.使用无磷洗衣粉 D.使用无氟冰箱
15.下列有关说法正确的是
A.家用食盐是纯净物
B.乙烯、苯分子中所以原子共平面
C.实验室用苯、溴水、三氯化铁制备溴苯
D.硝基、羟基、氯原子、苯环、甲基都是官能团
16. 能正确表示下列化学反应的离子方程式是
A.氯化铝溶液中加过量的氢氧化钠 A13++4OH—==A1O2-+2H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+==Ca2++2H2O
C.铜片插入硝酸银溶液中Cu+Ag+==Cu2++Ag
D.碳酸钙溶于稀盐酸中CO32-+2H+==H2O+CO2↑
17. 市场上销售的“84”消毒液,其商品标识上有如下叙述:本品为无色液体,呈碱性,使用时
加入水稀释,可对餐具、衣物进行消毒,也可漂白浅色衣物.据此可推测有效成分可能是
A.Cl2 B.SO2 C.KMnO4 D .NaClO
18.直馏汽油与裂化汽油的鉴别方法是
A.水 B.酸性高锰酸钾溶液 C.蛋白质 D.硫酸铜晶体
19.下列有关环境保护的说法中错误的是
A.含氮、磷化合物的生活污水大量排放可使水体富营养化
B.各国工业大量排放二氧化硫是全球气候变暖的主要原因
C.劣质装修材料中的甲醛、苯、氡气等对人体有害
D.废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染
20.放热反应一定是
A.反应物的总能量高于生成物的总能量
B.反应物的总能量低于生成物的总能量
C.反应物的总能量等于生成物的总能量
D.断开旧键吸收的能量大于形成新键放出的能量
21.下列反应中,属于加成反应的是
A.CH3Cl+Cl2→CH2Cl2+HCl B.CH2=CH2+HCl→CH3CH2Cl
C.SO2+2NaOH→Na2SO3+H2O D.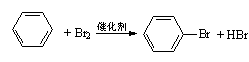
22.下列有关物质用途的说法中,正确的是
①硅可用来制造半导体材料 ②二氧化硅可用于制造光导纤维
③碳酸氢钠可用于治疗胃酸过多 ④铝合金可用于制造飞机
A.只有①② B.只有③④ C.只有②③④ D.①②③④
23.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器
中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
第 二 卷(非选择题 共31分)
二、(本题共4小题,共22分)
24.(5分)某校食堂中餐食谱如下:
主食:大米饭
配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤 炒猪肝
主食和配菜中主要含维生素、__________、_________、__________、无机盐和水等营养素,
考虑到各种营养成分的均衡搭配,应该增加含VC的配菜是_____________。
25.(5分)有下列各组微粒或物质: CH3
![]() A:C60和C70 B:
A:C60和C70 B:![]() C和
C和![]() C C:CH3CH2CH2CH3和CH3CH2CHCH3
C C:CH3CH2CH2CH3和CH3CH2CHCH3
![]()
![]()
![]() H
Cl
CH3
H
Cl
CH3
![]()
![]() D:Cl—C—Cl和Cl—C—H
E:CH3CH2CH2CH3和CH3—CH—CH3
D:Cl—C—Cl和Cl—C—H
E:CH3CH2CH2CH3和CH3—CH—CH3
H H
① 组两种微粒互为同位素; ② 组两种物质互为同素异形体;
③ 组两种物质属于同系物; ④ 组两物质互为同分异构体;
⑤ 组两物质是同一物质。
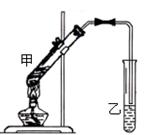 26.(6分)
右图是实验室制备乙酸乙酯的实验装置图。按图连接好装置,加入试剂,用酒精灯小心均匀地加热试管3~5 min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。则:
26.(6分)
右图是实验室制备乙酸乙酯的实验装置图。按图连接好装置,加入试剂,用酒精灯小心均匀地加热试管3~5 min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。则:
证明有乙酸乙酯生成的实验现象是盛有碳酸钠溶液的试管中, 。根据实验中有关乙酸乙酯的试验现象,叙述其物理性质:
生成乙酸乙酯的化学方程式是 ;
属于 反应类型(填A氧化、B还原、C取代、D加成)。
27.(6分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。
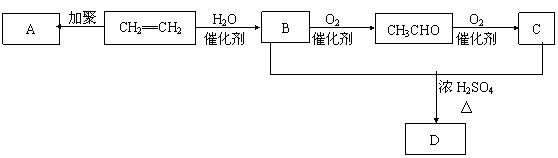 |
据此回答下列问题。
(1)指出B→CH3CHO的反应类型(选填氧化或加成反应)_____________。
(2)写出A的结构简式__________________。
(3)写出CH2==CH2→B的化学反应方程式 。
三、(本题只有1小题,共9分)
28.海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时,若配制1000mL0.20mol/LNaOH溶液,计算称量固体NaOH的质量。
(2)取初步净化处理的浓缩海水100mL,加入200mL0.20mol/LNaOH溶液,恰好将其中的Mg2+完全沉淀,求浓缩海水中Mg2+的物质的量浓度。
(3)研究小组同学把上述沉淀过滤,向滤液中加入足量的氯化钡溶液,又能产生沉淀的量为多少?
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | C | C | B | D | D | C | C | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | A | D | B | A | D | B | B | A |
| 题号 | 21 | 22 | 23 | |||||||
| 答案 | B | D | D |
高一年级化学第二学期中测试试题
化学(非化学专业)试卷参考答案
24.(5分)糖类;蛋白质;油脂;蔬菜
25. B ;A; C; E; D
26.液体出现分层,上层液体有果香味(各1分) 不溶于饱和碳酸钠溶液、易挥发、密度比水小(2分
CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O (2分)C取代(2分)
CH3COOCH2CH3+H2O (2分)C取代(2分)
27.(1) 氧化反应 (2分) (2) ![]() (2分)
(2分)
(3) CH2=CH2
+ H2O![]() CH3CH2OH (2分)
CH3CH2OH (2分)
28.解:⑴配制氢氧化钠溶液需n(NaOH)=0.2mol/L*1.0L=0.2mol,m(NaOH)=0.2mol*40g/mol=8g
⑵海水中n(Mg2+) =0.20mol/L *0.2 L *1/2=0.02 mol, c(Mg2+)= 0.02 mol/0.1 L= 0.2mol/L
⑶n(BaSO4) =n(SO42-)= n(Mg2+)=0.02 mol, m(BaSO4)=4.66 g