高一年级化学第二学期回头考试卷
满分100分 考试时间90分钟 命题人:朱成明 校对人:王芳琴
相对原子质量:H:1 C:12 O:16 P:31 S:32 Fe:56 Ba:137
一、选择题(本题包括24小题,每小题2分,共48分。每小题只有一个正确选项)
1.放射性核素12553I可用于治疗肿瘤,该核素的中子数为 ( )
A.19 B.53 C.72 D.125
2.下列说法中正确的是 ( )
A.氧化剂本身发生氧化反应 B.氧化还原反应一定有氧元素参加
C.在反应中氧化剂得电子,还原剂失电子 D.氧化反应一定先于还原反应
3.工业盐酸常呈黄色,其原因是B
A.Cl-被空气中的O2氧化 B.混有可溶性杂质如Fe3+
C.溶有Cl2 D.HCl在溶液中呈黄色
4.下列说法正确的是 ( )
A.1 mol 氢的质量为1g B.等物质的量的O2和O3所含的O原子数目之比为2∶3
C.H3PO4的摩尔质量为98g D.6g 12C所含的原子数为阿伏加德罗常数
5.往浅绿色的Fe(NO3)2 溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是 ( )
A.绿色变深 B.变棕黄色 C.颜色变浅 D.无现象
6.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是 ( )
.... ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
7.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) ( )
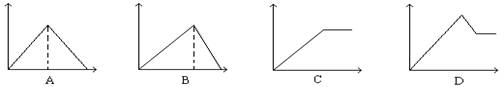
8.实现下列变化,一定要加入其它物质作还原剂的是 ( )
A.Na2SO3→Na2SO4 B.Cl2→NaCl C.FeCl3→FeCl2 D.NaHCO3→CO2
9.能用H++OH-=H2O离子方程式来表示的化学反应是 ( )
A.固体Cu(OH)2和H2SO4反应 B.澄清石灰水和HNO3溶液反应
C.KOH溶液和醋酸溶液反应 D.Ba(OH)2和H2SO4溶液反应
10.不用其他试剂无法鉴别的一组溶液是 ( )
A.氯化铁溶液和氯化铜溶液 B.硫酸钠溶液和氯化钠溶液
C.氯化铝溶液和氢氧化钠溶液 D.硫酸氢钠溶液和碳酸钠溶液
11.只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂是 ( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
12.向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是 ( )
A.Fe 2+、Cu2+ B.Fe 2+、Fe3+ C.Fe 3+、Cu2+ D.Cu+、Cu2+
13.某无色溶液中,可能大量共存的离子组是 ( ) AB
A.MnO4-、K+、Na+、SO42- B.K+、 H+、 CO32-、Cl-
C.Mg2+、NH4+、Cl-、NO3- D.Ba2+、K+、HCO3-、OH-
14.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
15.最新的研究表明:一氧化氮吸入治疗法可快速改善SARS中重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是 ( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮易溶于水,不能用排水法收集
D.一氧化氮可以由氮气和氧气在放电条件下直接化合得到
16.自来水常用氯气进行消毒.某实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是()
A.FeCl2 B.Na2SO3 C.NaOH D.AlCl3
17.向下列溶液通入CO2至过量的过程中,原溶液一直保持澄清的是 ( )
A.硅酸钠溶液 B.氯化钡溶 C.石灰水 D.漂白粉溶液
18.下列关于SO2的叙述,正确的是 ( ) A
A.SO2只能是含硫物质的氧化产物 B.SO2是亚硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液先变红后褪色
19.纯碱和小苏打是厨房中两种常见用品,它们都是白色固体,下列区分它们的说法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
20.设NA表示阿伏加德罗常数值,下列叙述正确的是 ( )
A.NA氧分子和NA氢分子的质量比等于16:1 B.11.2L H2中含有的原子数为NA个
C.54g H2O中含有原子数为3NA个 D.2L 1mol/L Na2SO4溶液中离子数为3NA个
21.在反应3Cl2+6KOH(浓)![]() KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为 ( )
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为 ( )
A.5:1 B.4:1 C.1:5 D.1:4
22.向50mL 18mol·L-的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量为 ( )
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
23.由反应8NH3+3Cl2=N2+6NH4Cl 可知,30mLCl2能氧化相同条件下的NH3 ( )
A.80mL B.40mL C.20mL D.10mL
24.将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是 ( )
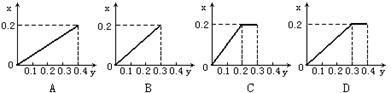 |
二、填空题(共4小题,每空2分,共40分)
25.(8分)用化学方程式表示下列有关实验过程:
⑴两只棉球分别滴有几滴浓氨水和浓盐酸放入同一只烧杯中,用表面皿盖住烧杯口,烧杯内有白烟:
___________________________________________________________;
⑵一瓶无色气体打开瓶盖后,瓶口呈现出红棕色:___________________________________;
⑶长期暴露在空气中的亚硫酸钠变质:__________________________________________;
⑷实验室制氯气的反应方程式:________________________________________。
26.(12分)今有HCl、Cl2、H2S、NH3、NO2、CO2、H2、SO2等气体,问:
⑴通常能形成酸雨的气体是____________________________;
⑵密度比空气轻的气体是____________________________;
⑶用水做溶剂,可作喷泉实验的氢化物是____________________________;
⑷能用碱石灰干燥的气体是____________________________;
⑸能使品红试液褪色的气体是____________________________;
⑹可导致光化学烟雾的气体是____________________________。
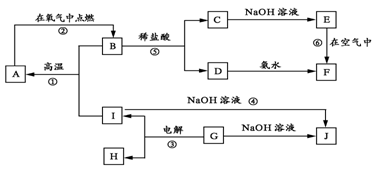 27.(8分) A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
27.(8分) A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是________(写元素符号)。
(2) 写出物质D的化学式:D_________。
(3) 写出反应①、④的化学方程式:
反应①:__________________________。反应④:___________________________。
| |
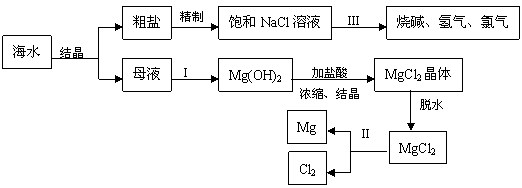
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中加入以下物质,最后使溶液呈中性。
①过量的Na2CO3溶液、②盐酸、③过量的NaOH溶液、④过量的BaCl2溶液则,加入的顺序是_________。
(2)写出加入最后一种试剂后可能发生的化学反应的离子方程式_________________、_______________.
(3)①写出反应Ⅰ的离子方程式
②写出反应Ⅱ的化学方程式
③写出反应Ⅲ的离子方程式 。
三、计算题(2小题,共12分)
29.(6分)取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)原混合液中Na2SO4的物质的量浓度为_________ mol ·L-1。
(2)产生的气体在标准状况下的体积为___________ L。
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应后溶液的体积为200mL)。
30.(6分)将铁与氧化铁的混合物15克,加入150mL稀硫酸中,标况下放出氢气1.68升,同时铁和氧化铁均无剩余,向溶液中滴加KSCN溶液,未见颜色变化。
(1)写出所有发生的反应方程式 。
(2)计算混合物中铁的质量。
(3)为了中和过量的硫酸,且使Fe2+转化为Fe(OH)2,共消耗3 mol·L-1的氢氧化钠溶液200mL,求原硫酸的物质的量浓度。
高一回头考化学参考答案
一、选择题(本题包括24小题,每小题2分,共48分。每小题只有一个正确选项)
1C 2C 3B 4B 5B 6D 7D 8C 9B 10B 11C 12A 13C 14A 15D 16A 17B 18B 19C 20A 21A 22D 23C 24D
二、填空题(共4小题,每空2分,共40分)
25.(8分,每空2分)
⑴NH3+HCl==NH4Cl ; ⑵ 2NO+O2==2NO2;
⑶2Na2SO3 + O2==2Na2SO4 ; ⑷MnO2+4HCl=MnCl2+Cl2+2H2O。
26.(12分,每空2分) ⑴NO2 、SO2 ; ⑵NH3、H2; ⑶HCl、NH3;
⑷NH3、H2; ⑸Cl2、SO2; ⑹NO2。
27.(8分,每空2分)
(1) Fe (2) FeCl3
(3) ①8Al + 3Fe3O4![]() 9Fe + 4Al2O3,
9Fe + 4Al2O3,
④2Al+2NaOH+2H2O=2NaAlO2+3H2
28.(12分,每空2分)(1) ④③①②或③④①②
(2) H++OH-==H2O 2H++CO32-==H2O+CO2↑
(3)①Mg2++Ca(OH)2==Mg(OH)2↓+Ca2+
② MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
③2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
三、计算题(2小题,共12分)
29.(1)0.2(2分)
(2)1.12 (2分)
(3)所得滤液溶质为NaOH。根据Na元素守恒得
n(NaOH)=2×[n(Na2SO4)+n(Na2CO3)]
=2×[![]() ]
]
=0.14mol
故 c(NaOH)=![]() =0.7mol/L (2分)
=0.7mol/L (2分)
30.(6分) (1) Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2(SO4)3+Fe=3FeSO4
Fe+H2SO4=FeSO4+H2 (2分)
(2) 7 (2分) (3) 2 mol·L-1(2分)