高一年级化学第二学期期末模拟检测试题
(考试时间:90分钟 命题人:朱成明 校对人:王芳琴)
说明:1.本试卷前100分折算成80分,加上附加题20分,满分仍为100分。
2.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Al 27 Cl 35.5 Br 80
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有一个正确答案。)
1.下列化学名词正确的是
A.溴笨 B.氨基酸 C.乙酸乙脂 D.氯化氨
2.减少酸雨产生的合理措施是
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸性土壤中加入石灰 ⑤用煤作燃料
A.①②⑤ B.①②③④ C.②③ D.②④⑤
3.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A.4 3He B.3 2He C.4 2He D.3 3He
4.下列不属于天然高分子化合物的是
A.淀粉 B.纤维素 C.油脂 D.蛋白质
5.下列各组互为同素异形体的是
A.氕和氘 B.氧气和臭氧 C.水和过氧化氢 D.烧碱和纯碱
6.下列分子中,同时含有离子键和共价键的是
A.CO2 B.H2O C.Br2 D.Na2O2
7.在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4 B.CH4和C2H6 C.C2H4和C2H6 D.C3H4和C3H6
8.下列关于物质性质变化的比较, 不正确的是
A. 酸性强弱: HI >
HBr > HCl > HF
B. 原子半径大小: Na > S > O
C. 碱性强弱: KOH > NaOH > LiOH
D. 还原性强弱: F-
> Cl- > I-
9.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是
A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
10.现代以石油化工为基础的三大合成材料是:①合成氨 ②塑料 ③合成盐酸 ④合成橡胶 ⑤合成尿素 ⑥合成纤维 ⑦合成洗涤剂
A.②④⑥ B.②④⑦ C.①③⑤ D.④⑤⑥
11.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种离子半径大小的顺序是
A. B>A>C B. C>A>B C.A>B>C D.C>B>A
12.下列关于乙烯和聚乙烯的叙述不正确的是
A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物
B.乙烯的化学性质比聚乙烯活泼
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.乙烯和聚乙烯都能使溴水褪色
13.用铁片与稀硫酸反应制取氢气时,下列的措施中,不能使氢气生成速率加快的是
A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
14.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式正确的是:
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) △H= +890kJ·mol—
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= +890kJ·mol—
C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H=-890kJ·mol—
D.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890kJ·mol—
15.下列关于化学反应速率的说法,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率的大小主要取决于反应物的性质
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有:mol·L-1·s-1和mol·L-1·min-1
16.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
17.下列说法正确的是
A.化学反应中的能量变化都表现为热量的变化 B.需要加热才能发生的反应一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小
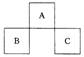 18.A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素
18.A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素
原子序数的4倍。则A、B、C分别是
A.C、Al、P B.N、Si、S C.O、P、Cl D.F、S、Ar
![]() 19.根据CH2=CH—CH2COOH的结构,它不可能发生的反应是
19.根据CH2=CH—CH2COOH的结构,它不可能发生的反应是
CH3
A.水解反应 B.使溴的四氯化碳溶液褪色
C.与乙醇在浓硫酸催化下发生酯化反应 D.与碳酸钠溶液反应
20.反应4NH3(g)
+ 5O2(g)![]() 4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
A.v (O2)= 0.01mol·(L·s)–1 B.v (NO)= 0.008mol·(L·s)–1
C.v (H2O)= 0.003mol·(L·s)–1 D.v (NH3)= 0.02mol·(L·s)–1
21.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是
 A.混合气体中一定有甲烷 B.混合气体中一定是甲烷和乙烯
A.混合气体中一定有甲烷 B.混合气体中一定是甲烷和乙烯
C.混合气体中一定有乙烷 D.混合气体中一定有乙炔(CH≡CH)
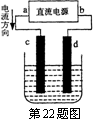
22.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为正极、b为负极 B.a为阳极、b为阴极
C.电解过程中,d电极质量不变 D.电解过程中,氯离子浓度不变
23.只用一种试剂就可以鉴别苯、碘化钾溶液、硝酸银溶液、己烯、四氯化碳,这种试剂是
A.NaOH溶液 B.KMn04溶液 C.溴水 D.Na2C03
二、填空、简答题(本题包括5小题,共42分)
24.(5分)有下列各组微粒或物质: CH3
![]() A.O2和O3
B.
A.O2和O3
B.![]() C和
C和![]() C C.CH3CH2CH2CH3和CH3CH2CHCH3
C C.CH3CH2CH2CH3和CH3CH2CHCH3
![]()
![]()
![]() H
Cl
CH3
H
Cl
CH3
![]()
![]() D.Cl—C—Cl和Cl—C—H E.CH3CH2CH2CH3和CH3—CH—CH3
D.Cl—C—Cl和Cl—C—H E.CH3CH2CH2CH3和CH3—CH—CH3
H H
(1) 组两种微粒互为同位素; (2) 组两种物质互为同素异形体;
(3) 组两种物质属于同系物; (4) 组两物质互为同分异构体;
(5) 组两物质是同一物质。
25.(8分)A、B、C、D四种短周期元素, A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号________;
(2)C的负价阴离子的结构示意图________________;
(3)C、D两元素形成的化合物的电子式 _____________。
(4)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是( )。
A.将这两种元素的块状单质分别放入冷水中 B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性
26.(10分)某有机物A,由C、H、O三种元素组成。已知B是石油化工发展水平的标志,在一定条件下由B可以转变为有机物A、C、D、E、F。转变关系如下:

(1)写出A、B、E、F的结构简式:
A B E F
(2)写出实现下列转化的化学方程式,并注明反应类型
![]() D E
_____________________________________________________、__________________
D E
_____________________________________________________、__________________
![]() B C
______________________________________________________、_________________
B C
______________________________________________________、_________________
 27.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
27.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
(1)电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 ______。
(2)Y电极上的电极反应式为 ___________________;
检验该电极反应产物的方法是 ___________。
28.(11分)某有机物的结构简式为HOOC—CH=CH—CH2OH。
⑴请你写出该有机物官能团的名称:__________、_______________、__________________。
⑵验证该有机物中含有-COOH所用的试剂是_________,实验现象______________________。
(3)验证该有机物中含有C=C所用的试剂是__________,实验现象_______________________。
三、计算题(本题包括2小题,共12分)
29.(6分)标准状况下,将甲烷和乙烯的混合物224mL通入装有足量溴的四氯化碳溶液的试剂瓶,试剂瓶增重0.084g,试写出化学反应方程式并计算甲烷和乙烯的体积比。
30.(6分)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min)。
xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min)。
求:(1)反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
四、附加题(本题包括2小题,共20分)
31.(10分) A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单键。试填写下列空白。
(1)五种元素的名称是A B C D E
(2)C在B中燃烧生成的化合物的电子式为 ;
(3)E的氢化物与D的最高价氧化物的水化物反应的离子方程式: _______;
C的最高价氧化物的水化物与D的最高价氧化物的水化物的反应的离子方程式为 ______。
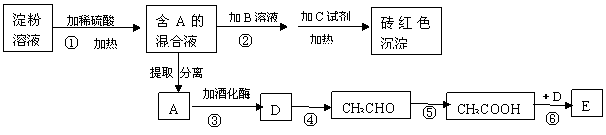 32.(10分)根据下列变化关系,请回答下列问题:
32.(10分)根据下列变化关系,请回答下列问题:
(1)写出A物质的名称_________ 。加B溶液的作用为______________________________________。
(2)写出④、⑥两步反应的化学方程式,并在( )号中标明反应类型。
④ ___________________________________________________( );
⑥____________________________________________________ ( )。

![]() 高一年级化学第二学期期末模拟检测试题
高一年级化学第二学期期末模拟检测试题
| 座位号 |
|
高一年级化学答题卷
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有一个正确答案。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
二、填空、简答题(本题包括5小题,共42分)
24.(5分)
(1) ; (2) ; (3) ; (4) ; (5) 。
25.(8分):
(1)_____________;(2)______________________;(3)__________________。(4)( )。
26.(10分)
(1)A B E F
![]() (2) D E
_____________________________________________________、__________________;
(2) D E
_____________________________________________________、__________________;
![]() B C
_____________________________________________________、________________。
B C
_____________________________________________________、________________。
27.(8分)
(1) _______________________________;
_______________________________。
(2) __; ________________________。
28.(11)
⑴ __________、_______________、__________________。
⑵ _______________________, ________________________________________________。
(3) ______________________, ________________________________________________。
三、计算题(本题包括2小题,共12分)
29.(6分)
30.(6分)
四、附加题(本题包括2小题,共20分)
31.(10分)
(1)五种元素的名称是A B C D E
(2) ;
(3) _______; __________________________________。
32.(10分)
(1) _________ 。____________________________________________。
(2) ④ ___________________________________________________( );
⑥____________________________________________________ ( )。
高一年级化学参考答案
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有一个正确答案。)
1B 2C 3B 4C 5B 6D 7A 8C 9C 10A 11A 12D 13B 14C 15C 16D 17D 18C 19C 20C 21A 22A 23C
二、填空、简答题(本题包括5小题,共42分)
24.(5分) (1)B (2) A (3)C (4) E (5)D

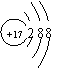
25.(8分)(1)Mg(2) (3) (4)B C
26.(10分) (1) A: CH3CH2OH B: CH2=CH2 E: CH3COOH F: CH3COOC2H5
![]() (2)D E 2CH3CHO + O2
(2)D E 2CH3CHO + O2
![]() 2CH3COOH (氧化反应)
2CH3COOH (氧化反应)
![]() B C CH2=CH2
+ HBr
B C CH2=CH2
+ HBr![]() CH3CH2Br (加成反应)
CH3CH2Br (加成反应)
27.(8分)(1)2NaCl + 2H2O==2NaOH + Cl2↑+ H2↑; 酚酞变红,有气泡产生。
(2)2Cl- - 2e- == Cl2↑,用湿润的淀粉碘化钾试纸放在Y极附近观察现象
28. (11分)⑴羧基 、碳碳双键、羟基(3分) 。
⑵ Na2CO3溶液或石蕊试液(其他合理答案都得分),产生气泡或变红(2分)
(3)溴的四氯化碳溶液或酸性高锰酸钾溶液 (其他合理答案都得分),褪色(2分) 。
三、计算题(本题包括2小题,共12分)
29.(6分)方程式2分(2分),7∶3 (4分)
30.(6分)解:设A、B起始时物质的量为a mol
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始 a a 0 0
变化 1.5 0.5 0.1×2×5 0.5×2
5min后 a-1.5 a-0.5 1 1
![]()
a=3 A、B各为3mol (2分) 因C、D变化的量相等,x=2 (2分)
v(B)=![]() v(C)
v(C)
v(B)=0.05mol/(L·min) (2分)
四、附加题(本题包括2小题,共20分)
31.(10分) (1) 碳、氧、钠、铝、氯 (2)
![]()
(3) 3H++Al(OH)3=3H2O+Al3+ OH- + Al(OH)3 = AlO2- + 2H2O
32.(10分)1)葡萄糖(2分) 中和稀H2SO4(2分)
![]()
(2)2CH3CH2OH+O2 2CH3CHO+2H2O(氧化反应)
![]() CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O(酯化反应或取代反应)(方程式2分,类型1分)
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O(酯化反应或取代反应)(方程式2分,类型1分)
前100分分值分配:专题一24分 专题二36分 专题三38分 专题四2分