非金属及其化合物
本卷可能用到的相对原子量:
H-1 C-12 N- 14 O-16 Na-23 Mg-24 Al-27 Fe-56 Cu-64
一、 选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项题意。)
1.环保部门测得某市的空气里的成分有①N2,②O2,③CO2,④Ar,⑤SO2,⑥NO2,⑦可吸入碳颗粒。其中导致酸雨的是( )
A.③⑤⑥ B.⑤⑥ C.④⑤⑦ D.除①②以外
2.光导纤维传输信息容量大,而且抗干扰、防窃听、不腐蚀,制光导纤维的材料是( )。
A.晶体硅 B.二氧化硅 C.硅酸盐 D.铝硅合金
3. 保存下列物质的正确方法是
A.氢氟酸保存在用塑料盖的玻璃瓶中 B.热的浓硫酸可用铁桶贮存
C.氯水盛放在棕色细口试剂瓶中 D.水玻璃保存在带有玻璃塞的玻璃瓶中
4.下列四个反应中水起的作用与其它不相同的是 ①Cl2+H2O、 ②NO2+H2O、 ③Na+H2O、 ④ NH3+H2O、( )。
A.① B.② C.③ D.④
5.下列物质中,按其成分能与玻璃、水泥、陶瓷归于同一类的是( )。
A.硅石 B.碳化硅 C.硅酸钠 D.二氧化硅
6.生石灰中含有碳酸钙和二氧化硅,要检验这两种杂质是否存在,选用的试剂最好是( )。
A.稀盐酸 B.水 C.烧碱溶液 D.稀硫酸
7.在2H2SO4(浓)+ Cu ====CuSO4+SO2↑ + 2H2O反应中,还原剂与氧化剂物质的量之比为( )
A.32∶49 B.1∶1 C.1∶2 D.2∶1
8.不能用检验新制氯水和长期放置的氯水的试剂是( )。
A.石蕊试液 B.品红溶液 C.FeCl2溶液 D.AgNO3溶液
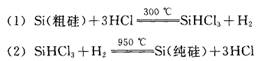 9.制造太阳能电池需要高纯度的硅,工业上制高纯硅常利用以下反应来实现:
9.制造太阳能电池需要高纯度的硅,工业上制高纯硅常利用以下反应来实现:
对上述两个反应的下列叙述中,错误的是( )。
A.两个反应都是置换反应 B.两个反应中的H2均作为还原剂
C.两个反应都要在耐腐蚀的容器中进行 D.两个反应都是氧化还原反应
10.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是( )
| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4 mol·L—1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol·L—1盐酸 |
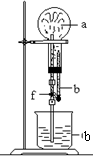
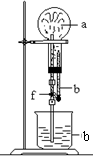
A. ①和② B. ③和④ C. ①和③ D. ②和④
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11. NA为阿佛加德罗常数,下述正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.标准状况下,22.4L四氯化碳所含分子数为 NA
C.1L的NaCl溶液中,所含离子总数为2NA
D.标准状况下,22 .4升氦气含有NA个原子数
12. 一定量的浓硝酸和过量的铜充分反应,产生的气体有( )
① NO2 ② NO ③ NH3 ④ H2
A.只有① B.①② C.①③ D.①②④
13. 下列的各组离子在酸性溶液中能大量共存的是( )
A、Na+、Fe2+、、NO3-、SCN— B、Ca2+、K+、Cl—、NO3—
C、Al3+、K+、OH—、NO3— D、Na+、Ca2+、SiO32—、Cl—
14. 下列关于浓硝酸和浓硫酸的叙述正确的是( )。
A.都是常用的干燥剂
B.分别露置在空气中,容器内溶质的物质的量浓度都降低
C.都可以储存于铝制槽罐中
D.和铜反应中都只表现出强氧化性
15. 下列反应的离子方程式错误的是( )
A. 碳酸铵和稀硝酸: CO32— + 2H+ == H2O + CO2↑
B. AlCl3溶液和过量的氨水: Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+
C. 铁粉和稀硫酸: Fe + 2H+ == Fe3+ + H2↑
D. Cl2通入NaOH溶液: Cl2 + 2OH— == Cl— + ClO— + H2O
16. 下列气体中,既能用浓硫酸干燥,又能用碱石灰干燥的( )
A.C12 B.NH3 C.CO2 D.O2
非金属及其化合物
班别 学号 姓名 成绩
三、填空题(共37分)
17.(16分)为了探究氯水的成份,某学生在氯水中分别加入下列物质,请分别写出实验的现象,结论(写分子或离子的化学式)和离子方程式
(1) 紫色石蕊试液
(2) FeCl2溶液
(3) Na2CO3溶液
(4) AgNO3—HNO3溶液
18.(12分)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
![]() ① A + H2O → B + C ② C + F → D ③ D + NaOH F + E + H2O
① A + H2O → B + C ② C + F → D ③ D + NaOH F + E + H2O
(1)写出它们的化学式:A 、C 、F ;
(2)写出各步反应的离子方程式,并指反应①的氧化剂
① 、氧化剂
②
③
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式 。
19.(9分)根据下图回答问题:
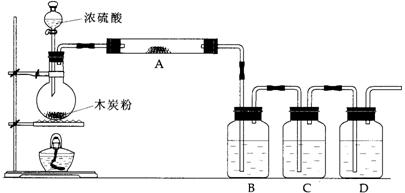
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:(C中加入的试剂是酸性KMnO4溶液能除尽SO2气体而褪色)
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
D中加入的试剂是 ,作用是 。
四.(9分)计算题(要求写具体的解题过程、符号要规范)
20.有铜和氧化铜的混合物加入稀硝酸中收集到气体2.24L(标况),求被硝酸氧化的铜多少克?
17.(1) 紫色石蕊试液变红后褪色,有H+、HClO: Cl2 + H2O ==H++Cl-+HClO ;
(2) 浅绿色溶液变为黄色,有Cl2: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(3) 有汽泡产生,有H+: 2H++CO32-= H2O+ CO2↑
![]() (4) 产生白色沉淀,有Cl—: Ag+ + Cl- = AgCl↓
(4) 产生白色沉淀,有Cl—: Ag+ + Cl- = AgCl↓
18.(1)A NO2 B NO C HNO3 D NH4NO3 E NaNO3 F NH3
|
|
(3)4NH3 + 5O2 ====== 4NO + 6H2O
19、(1)答:反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。
(2)2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)无水硫酸铜 检验 H2O
品红溶液 检验 SO2
澄清石灰水 检验 CO2
(4) 导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
20. 9.6g