|
高( 一 )学年 化学 试卷
考试时间:90分钟 试卷满分:100分
试卷I( 共50分)
本试卷参考元素相对原子质量:N 14 H 1 O 16 C 12 Mg 24 Cl 35.5 Al 27
Na 23 S 32
一 选择题(本题共10道小题,每小题2分,共20分。每题只有一个正确选项。)
1.氧化还原反应的本质是( )
A.得氧和失氧 B.化合价的升降 C.有无新物质生成 D.电子的转移
2.下列各组离子在溶液中可以大量共存的是( )
A. H+.CO32—.NO3—.SO42— B. Ba2+.Cl—.NO3—.CO32—
C.Cu2+.H+.SO42—.Cl— D. Ag+.OH—.CO32—.H+
3.盛浓H2SO4的试剂瓶贴图中最合适的标志是( )



A B C D
4.今有下列物质:①1molNH3 ②标准状况下11.2LN2 ③40C时10mL水④标准状况下22.4LCH4 。原子数由多到少的顺序是( )
A.④③①② B.④②①③ C.②④①③ D.④①③②
5.下列变化中,属于化学变化的是( )
A.用CCL4从碘水中萃取碘单质
B.Cu(NO3)2 溶液与Na2SO4 溶液混合后溶液呈蓝色
C.从海水中提取蒸馏水
D.久置于空气中的石灰水变浑浊
6. 下列说法正确的是( )
A.摩尔只适用于微观粒子,它是国际七个基本物理量之一
B.在同温同压下,气体体积的大小主要由气体分子数决定
C.二氧化碳的摩尔质量为44 g
D.0.5mol的Mg与足量的盐酸反应转移电子数为3.01×1023
7.下列化学反应中,离子方程式表示正确的是 ( )
A.石灰石溶解在稀HCl中 CO32— + 2H+ == CO2↑+ H2O
B.铁屑在稀H2SO4作用下产生H2 Fe + 2H+ === Fe2+ + H2↑
C.NaHCO3溶液与NaOH溶液反应 H+ + OH— == H2O
D.H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42— + Ba2+== BaSO4↓
8.在无色透明的未知溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则未知液中一定大量存在( )
A. Ag+ B. SO42- C. Ag+ 和SO42- D.Ag+ 或SO42-
9.下列反应中,水作为还原剂的是( )
A.2Na +2H2O === 2NaOH + H2↑ B.Cl2 + H2O ==== HCl + HClO
C.2F2 + 2H2O === 4HF + O2 D.SO3 + H2O == H2SO4
10. 下列叙述中,正确的是( )
A.含非金属元素的离子一定都是阴离子
B.非金属元素从化合态变为游离态时,该元素一定被氧化
C.金属元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子一定只具有氧化性,不具有还原性
二 选择题(本题共10道小题,每题3分,共30分。有1到2个正确选项。)
11.下列反应是氧化还原反应的是( )
A.S2- + 2H+ = H2S↑
B.2Fe3+ + Fe = 3 Fe2+
C.NH4Cl + NaOH = NH3•H2O + NaCl
D.MnO2 + 4HCl = MnCl2 + Cl2↑+ 2H2O
12.下列说法正确的是( )
A.NaCl溶于水在电流作用下电离成钠离子和氯离子
B.电离时生成的阳离子全部是H+ 的化合物叫做酸
C.CO2 的水溶液能导电,所以CO2 是电解质
D.固体NaCl不导电,液态氯化氢能导电
13.下列说法中正确的是( )
A.1mol某气体的体积为22.4L,该气体所处的状态不一定是标准状况
B.将22.4L氯化氢气体溶解于水并配成1L溶液,所得溶液浓度为1mol•L-1
C.任何状况下,1molCO2和18gH2O所含的分子数和原子数都相等
D.20ml0.1mol/L的AlCl3溶液中的Cl-的物质的量浓度小于50mL0.2mol/L的NaCl溶液中的Cl-的物质的量浓度
14.在一定条件下,氯酸钾与碘按下式发生反应:2KClO3+I2=2KIO3+Cl2。由此可以推断下列相应的结论不正确的是( )
A.该反应属于置换反应 B.还原性:I2>Cl2
C.氧化性:I2>Cl2 D.氧化性:KClO3>I2
15.为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行五项操作,①过滤 ②加过量的氢氧化钠溶液 ③加适量的盐酸 ④加过量碳酸钠溶液 ⑤加过量的氯化钡溶液 正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
16.在两个容积相同的容器里,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的( )
A.原子数 B.密度 C.质量 D.质子数
17.下列说法正确的是( )
A.浓硝酸存放在棕色广口试剂瓶中
B.少量的浓硫酸沾到皮肤上,可用大量的水冲洗
C.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
D.用量筒量取12.35mL盐酸
18.在氧化还原反应中,下列各组物质都可以做氧化剂的是( )
A.F—.Cl—.S2— B. Fe3+.MnO4—.NO3— C. ClO4—.Mg.Na+ D. Cl2.Fe3+.Al
19. 5.5g某气体中含有7.525×1022 个气体分子,则该气体可能为( )
A. CO2 B. CO C. N2 D.O2
20.下列关于胶体和溶液的叙述正确的是( )
A. 胶体为分散质粒子直径在10nm~100nm之间的分散系
B. 可利用过滤的方法分离胶体和溶液
C.溶液是混合物,胶体是纯净物
D.利用丁达尔效应可以区别胶体和溶液
试卷II (共50分)
21.(10分)为下列混合物的分离或提纯提供正确的方法:
a、分离饱和食盐水和沙子的混合物 ;
b、分离水和汽油的混合物 ;
c、分离四氯化碳(沸点为76.750C)和甲苯(有机溶剂,与CCl4互溶。沸点为110.60C)的混合物 ;
d、从碘的水溶液里提取碘 ;
e、从食盐水中提取氯化钠 。
22. (9分)(1)下图所示的仪器名称为:
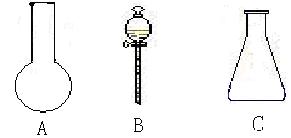
A ; B ;C 。
(2).指出下图所示实验中的错误之处:
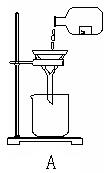
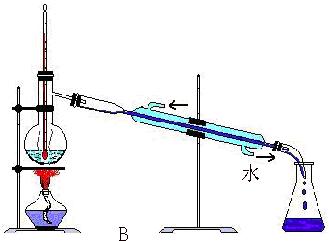
A.
;
B.
。
23. (12分)实验室要配制250mL 0.8mol·L-1 的NaOH溶液。
(1)需称取NaOH固体的质量为 g 。
(2)在下列仪器中:①托盘天平(带砝码盒);②量筒;③烧杯;④玻璃棒;
⑤漏斗;⑥500mL容量瓶;⑦药匙;⑧250mL容量瓶;⑨胶头滴管;⑩坩埚。
A、实验过程中必须用到的仪器有: (填写代号)。
B、容量瓶使用前应 。
(3)实验时该同学操作步骤如下,请将步骤C补充完整。
A、在烧杯中将已称量好的NaOH用蒸馏水充分溶解;
B、将NaOH溶液沿玻璃棒注入所选的容量瓶中;
C、 ;
D、振荡,继续向容量瓶中加水直到液面接近刻度线1—2cm处;
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
F、将容量瓶盖紧,摇匀。
(4)进行操作B前还需注意 ; 若不进行C操作,则会使所配溶液浓度 (填“偏大”、“偏小”或“不变”),若进行E操作时仰视则会使所配溶液浓度 (同前) 。
24.(8分)有一包粉末可能由NaCl 、Na2SO4 、Na2CO3 、FeCl3 、Ca(NO3)2 中的一种或几种组成。现作如下实验:①.取少量粉末加水溶解得无色透明溶液; ②.向①所得溶液中加入稀盐酸,收集到无色无味气体;③.向②所得溶液,加入稀硝酸酸化的硝酸银溶液,观察到有白色沉淀生成。
(1)原粉末中一定没有的物质是 ; 原粉末中一定有的物质是 。
(2)完成该检验过程中所涉及的化学反应的离子方程式:
;
。
25.(6分)在Cu + 2H2SO4(浓)![]() CuSO4
+ SO2↑+ 2H2O反应中,
CuSO4
+ SO2↑+ 2H2O反应中,
(1). 元素被氧化, 是氧化剂。
(2).用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓)![]() CuSO4
+ SO2↑+ 2H2O
CuSO4
+ SO2↑+ 2H2O
(3).若有2.4mol的H2SO4参与反应,则被还原的H2SO4为 g 。
26.(5分) 在标准状况下将448mL的氯化氢溶于水,配制成250mL溶液
(1).求所得盐酸的物质的量浓度?
(2).若该盐酸的密度为a g/mL ,则该盐酸的氯化氢溶质质量分数为多少?
![]()

高( 一 )学年 化学 试卷答题卡
| 题号 | 1-10 | 11-20 | 21 | 22 | 23 | 24 | 25 | 26 | 总分 |
| 得分 |
一、二.选择题: 共50分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 18 | 20 |
21.
a、 ; b、 ;
c、 ;d、 ;
e、 。
22. (1)
A ; B ;C 。
(2)
A.
;
B.
。
23.
(1) g 。
(2)A、 。 B、 。
(3)C、 。
(4) ; , 。
24.
(1) ; 。
(2)
;
。
25.
(1). , 。
(2).
Cu + 2H2SO4(浓)![]() CuSO4
+ SO2↑+ 2H2O
CuSO4
+ SO2↑+ 2H2O
(3). g 。
26.
(1).
(2).
![]()

高( 一 )学年 化学 试卷答题卡
| 题号 | 1-10 | 11-20 | 21 | 22 | 23 | 24 | 25 | 26 | 总分 |
| 得分 |
一、二.选择题: 共50分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | A | D | D | B | B | D | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 18 | 20 |
| BD | B | AC | C | CD | A | B | B | A | D |
21.
a、 过滤 ; b、 分液 ;
c、 蒸馏 ;d、 萃取 ;
e、 蒸发 。
22. (1)
A 圆底烧瓶 ; B 分液漏斗 ;C 锥形瓶 。
(2)
A. 漏斗下端未靠紧烧杯内壁;未使用玻璃棒引流;用试剂瓶,未用烧杯。
;
B. 没放石棉网;温度计的水银球插入液体中;冷凝管上口进水,下口出水。
。
23.
(1) 8.0 g 。
(2)A、 ①③④⑦⑧⑨ 。 B、 检查是否漏水 。
(3)C、 用蒸馏水洗涤烧杯2-3次并将洗涤液转移入容量瓶 。
(4) 将溶液冷却至室温 ; 偏小 , 偏小 。
24.
(1)FeCl3 、Ca(NO3)2 ; Na2CO3 。
(2)
CO32- + 2H+ = CO2 ↑ + H2O ;
Ag+ + Cl_ = AgCl↓ 。
25.
(1). Cu , 浓H2SO4 。
(2).
Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(3). 117.6 g 。
26.
(1). 0.08 mol•L-1
(2). 0.292ⅹ10-3/a %