高一化学![]()
 第二学期期中考试试卷
第二学期期中考试试卷
说明:1.试题共五大题26小题,分值:120分;
2.考试时限:100min;
| 题号 | 一、二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
|
|
|
|
|
|
一、第一专题选择题(本题包括12小题,每小题3分,共36分。每题只有一个选项符合题意,请把答案填入对应的答题卡中。)
1.下列有关化学用语,正确的是
![]()
![]() A.碳酸氢钙的化学式 CaHCO3 B.乙烯的最简式C2H2
A.碳酸氢钙的化学式 CaHCO3 B.乙烯的最简式C2H2
C.二氧化碳的电子式 D.氟离子的结构示意图
2.经过分析发现,![]() Co在医疗上常用于肿瘤的放射治疗,其中数字60表示
Co在医疗上常用于肿瘤的放射治疗,其中数字60表示
A.钴元素的相对原子质量 B.钴的一种同位素的质量数
C.钴的一种同位素的相对原子质量 D.钴元素的质量
3.我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源—“氦—3”,10t氦—3就能满足我国一年所有的能源需求。关于氦的该种核素应表示为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4.元素周期性变化的根本原因是
A.元素的相对原子质量逐渐增大 B.核外电子排布的周期性变化
C.原子核内质子数逐渐增大 D.元素化合价的周期性变化
5.下列各组物质的性质顺序,不正确的是
A.原子半径:Li<Na<Al B.热稳定性:H2O>H2S>PH3
C.酸性强弱:H3PO4<H2SO4<HClO4 D.熔点:冰(蔗)糖>冰>
6.下面四种物质的属于共价化合物的是
A.烧碱 B.氯气 C.干冰 D.盐酸
7.根据硼在周期表中的位置,推测硼的最高价含氧酸化学式不可能是
A.H2BO4 B.H3BO3 C.HBO2 D.H2B4O7
8.下列物质中,不含离子键的是
A.(NH4)2SO4 B.BaSO4 C.H2SO4 D.Na2SO4·10H2O
9.NaHSO4溶于水的过程中,发生了变化的化学键有
A. 离子键 B. 离子键、共价键 C. 共价键 D. 化学键未发生变化
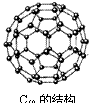 10.上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构(见右图),化学式为C60。下列说法中正确的是
10.上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构(见右图),化学式为C60。下列说法中正确的是
A.C60是一种新型的化合物
B.C60中含有离子键
C.C60和金刚石、石墨都是碳元素的不同单质
D.C60的摩尔质量为720g
11.关于结构的下列各种叙述,正确的是
A.分子晶体中,可能存在离子键
B.原子晶体的熔点一定比金属晶体的熔点高
C.原子晶体中,一定不存在离子
D.离子晶体中,一定存在阴离子
12.右下图为周期表中短周期的一部分。若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是
A.d的氢化物的沸点高于c的氢化物的沸点
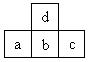 B.c的氢化物比a的氢化物稳定
B.c的氢化物比a的氢化物稳定
C.b和d可结合成![]() 和
和![]()
D.原子半径的大小顺序是c>b>a>d
二、第二专题选择题(本题包括11小题,每小题3分,共33分。每题只有一个选项符合题意,请把答案填入对应的答题卡中。)
13.下面哪一个条件的改变对反应速率没有影响
A.使用合适的催化剂 B.改变反应物的浓度
C.增大反应物的接触面积 D.把反应容器的试管换成烧杯
14.下列关于能量转换的认识中,不正确的是
A.AgBr见光分解时,主要发生,光能转化为化学能
B.甲烷燃烧是将全部的化学能转化为热能
C.电池长时间使用会发热,说明部分化学能转变成热能
D.光合作用是将太阳能转化成化学能
15.对于可逆反应A+B![]() C达到平衡时,下列说法正确的是
C达到平衡时,下列说法正确的是
A. 反应物A、B全部变成了C B. A、B、C三种物质的浓度一定相等
C. 反应已经停止 D. 反应混和物中各成分的质量比不再变化
16.下列过程中,一定释放出能量的是
A.化合反应 B.原子组合成分子
C.分子拆开成原子 D.分解反应
17.下列叙述正确的是
A.吸热反应在一定条件下,也能够进行
B.生石灰与水的反应是吸热反应
C.升高温度可以减慢放热反应速率
D.需要加热才能进行的反应一定是吸热反应
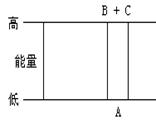 18.如右图所示,下列说法中正确的是
18.如右图所示,下列说法中正确的是
A.A=B+C和B+C=A两个反应吸收和放出的能量不等
B.A=B+C的过程是一个放热过程
C.物质A具有的能量高于B和C具有的能量总和
D.反应A=B+C是一个吸热过程,B+C=A必然是一个放热过程
19.下列说法错误的是
A.选择燃料只要考虑燃料燃烧值的大小就行
B.吸热反应的逆反应一定是放热反应
C.氢能是最有发展前途的能源
D.无论固体、液体还是气体的燃烧反应,都是△H<O
20.下列四个装置均盛放很稀的盐酸,其中铁棒腐蚀最慢的是
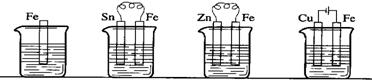 |
A. B. C. D.
21.下列能源不属于化石燃料的是
A.煤炭 B.石油 C.氢能 D.天然气
22.下列热化学方程式中,△H1比△H2小的是
(提示:△H<O时,绝对值越大,△H越小)
A.H2(g)+Cl2(g)=2HCl(g);△H1 2H2(g)+2Cl2(g)=4HCl(g);△H2
B.C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(s)+O2(g)=SO2(g);△H1 S(g)+O2(g)=SO2(g);△H2
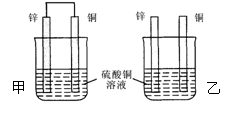 23.将纯锌片和纯铜片按图示方式插入同浓度的硫酸铜溶液中一段时间,以下叙述正确的是
23.将纯锌片和纯铜片按图示方式插入同浓度的硫酸铜溶液中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无明显现象
B.甲中铜片是正极,乙中锌片是负极
C.两烧杯的溶液中的c(Zn2+)均增大
D.甲中锌极发生氧化反应乙中铜极发生还原反应
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
|
|
24.(8分)指出下列原子的电子排布中,违反了哪些规律。
⑴ 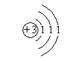
⑵ 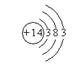
⑶ 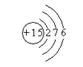
⑷ 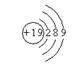
25.(8分)指出下列元素在周期表中的位置:
⑴ 元素原子只有一个电子层,电子层上有两个电子
⑵ ![]() X的元素
X的元素
⑶ 氘元素
⑷ 质子数与中子数相等的![]() 元素
元素
|
四、(本题共2小题,共23分)
26.(15分)下表是元素周期表的一部分。
|
| I A | ⅡA | ⅢA | IVA | VA | VIA | ⅦA |
| 1
| ① | ||||||
| 2
| ② | ③ | ④ | ⑤ | ⑥ | ||
| 3
| ⑦ | ⑧ | ⑨ | ⑩ | |||
⑴ 表中元素⑥的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
⑵ 表中某元素最高价氧化物对应的水化物酸性最强,则该元素的元素的名称是 ,其单质的电子式为 。
⑶ 用电子式表示元素①和⑩形成化合物过程:
。
⑷ 已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧。试分析的元素③氧化物属于 (填酸性或碱性或两性)氧化物;写出元素⑧的氢氧化物与NaOH溶液反应的化学方程式:
。
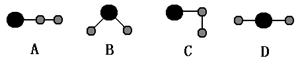 ⑸ 若用球棍模型表示①和⑥形成的化合物的分子结构,应该是
。
⑸ 若用球棍模型表示①和⑥形成的化合物的分子结构,应该是
。
27.(8分)如图所示,在室温下,把放入几小块镁片试管,小心地放入盛有(刚开瓶的)碳酸饮料的烧杯中,再用滴管滴加5mL稀盐酸于试管中。试回答下列问题:
⑴ 实验中观察到的现象是
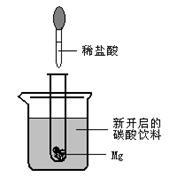 ;
;
⑵ 产生上述现象的原因是
;
⑶ 写出有关反应的离子方程式:
⑷ 由实验推知,MgCl2和H2的总能量 (填“大于”、“小于”、或“等于”)镁片和盐酸的总能量。
|
五、(本题共12分)
28.(12分)电解原理在化学工业中有广泛应用。右下图表示一个电解池,装有电解
液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
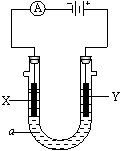 ⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ,
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
⑵ 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极反应式是 。
②Y电极的材料是 。
(说明:杂质发生的电极反应不必写出)
高一化学试卷参考答案
一、选择题(每小题只有一个选项符合题意,共36分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | B | A | B | A | C | A | C | B | C | D | D |
二、选择题(每小题有一个选项符合项意,共33分)
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | D | B | D | B | A | D | A | C | C | B | C |
三、填空题(本题包括2小题,共16分)
24.(8分)⑴违反了能量最低原理(2分);⑵违反了各电子层最多容纳2n2个电子(2分);⑶违反了能量最低原理(2分);⑷违反了最外层电子最多为8个的规定(2分);
25.(8分)⑴第一周期,零族(2分); ⑵第三周期,ⅦA(2分);
⑶⑴第一周期,ⅠA(2分); ⑷第二周期,ⅥA(2分)。
四、(本题包括2小题,共23分)
![]()
![]() 26.(15分)⑴H2O、(2分) 弱(2分)
26.(15分)⑴H2O、(2分) 弱(2分)
⑵氯(2分)、 (2分) ⑶ (2分)
⑷两性(1分) Al(OH)3+NaOH=NaAlO2 +2H2O(2分) ⑸ B (2分)
27.(8分)⑴镁片上有大量气泡,并逐渐溶解;烧杯液体里放出气泡的速率加快。(2分)
⑵盐酸与镁的反应是放热反应,碳酸饮料中CO2气体在水中的溶解度随温度升高而减小,所以烧杯中液体放出气泡的速率加快。(2分)
⑶Mg+2H+=Mg2++H2↑(2分) ⑷小于(2分)
五、(本题包括1小题,共12分)
28.(12分)⑴ ①2H+ + 2e - = H2↑;(2分) 放出气体,溶液变红。(2分)
②2Cl- - 2e- = Cl2 ↑;(2分)把湿润的KI淀粉试纸放在Y极支管口,试纸变蓝色。(2分)
⑵ ①Cu2+ + 2e - = Cu (2分); ②粗铜(2分)。
【答案提供人:张军】
【命题·校对 张 军】