高一化学第二学期期中考试试卷
本次考试中可能用到的相对原子质量:H—1、O—16、Mg—24、Al—27、Cl—35.5 N--14
第一卷 (共60分)
(请用2B铅笔将选择题的答案填涂在答题卡上)
一、选择题(每个小题只有一个选项符合题意,每小题2分,共60分)
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同种物质 B.同分异构体 C.同位素 D.同素异形体
2.下列气态氢化物中最不稳定的是
A. CH4 B. SiH4 C. H2O D. HCl
3.属同分异构体的是
A.正丁烷与异丁烷 B.16O与18O C.红磷与白磷 D.H2O与D2O
4.0.5mol Na2SO4中所含的Na+离子数为
A.3.01×1023 B.6.02×1023 C.0.5 D.1
5.元素R的阴离子Rn-核外有x个电子,其核内的中子数为m,则R的质量数是
A.x-n B.m-x+n C.m+x-n D.x+n
6.下列物质属于电解质的是
A.石墨 B.蔗糖 C.稀硫酸 D.NaC1
7.关于可逆反应达到平衡的说法错误的是
A.外界条件不能改变平衡 B.正、逆反应速率相等
C.各组分的含量不随时间而变化 D.是动态平衡
8.据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的是
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池汽车的使用可以有效减少城市空气污染
D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
9.在2A+B ==== 3C+4D反应中,表示该反应速率最快的是
A.υ(A)=0.5 mol·(L·s)-1 B.υ(B)=0.3 mol·(L·s)-1
C.υ(C)=0.8 mol·(L·s)-1 D.υ(D)=1 mol·(L·s)-1
|
A.Cl2 +
H2O ![]() HCl + HClO
B.2H2O ==== 2H2↑+
O2↑
HCl + HClO
B.2H2O ==== 2H2↑+
O2↑
C.2Na + 2H2O ==== 2NaOH + H2↑ D.CaO + H2O ==== Ca(OH)2
11.既能与盐酸反应,又能与NaOH溶液反应的是①Na2SiO3;②Al(OH)3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④ B.②④⑤ C.②③④ D.全部
12.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜
 C.把铜片插入三氯化铁溶液,在铜片表面析出铁
C.把铜片插入三氯化铁溶液,在铜片表面析出铁
D.把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快
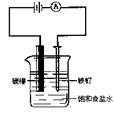
13.如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是
A.Cl2 B.O2 C.H2 D.HCl
14.若上题中电解的是未精制的饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是
A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡
15.国际上无机化学命名委员会于1989年规定,取消原长式周期表中主、副族族序号和“族”的概念,将元素周期表由左向右按顺序依次编为18列,如Na位于第1列,稀有气体元素的列序号为18,按照国际上这一新规定,下列各说法中正确的是
A.第1列全为金属元素 B.Al位于第13列
C.第15列的元素形成的化合物种类最多
D.原子最外层电子数为2的元素都位于第2列
16.共价键、离子键、金属键(金属离子与自由电子间的作用)、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是
A.SiO2 B.CO2 C.NaCl D.Na
17.下列物质熔沸点高低比较正确的是
A.SiO2<CO2 B.I2<Br2 C.Na<NaCl D.NaCl<HCl
18.下列各组离子,在强碱性溶液中可以大量共存的是
A.Cl-、Na+、CO32-、K+ B.Na+、NH4+、Cu2+、NO3-
C.Na+、K+、I-、Al3+ D.Ba2+、Fe3+、Cl-、AlO2-
19.下列反应的离子方程式书写正确的是
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- ==== AlO2-+ 2H2O
B.向小苏打溶液中加入醋酸溶液:HCO3- + H+ ==== CO2↑+ H2O
C.次氯酸钙溶液中通人过量二氧化碳Ca2++2ClO-+H2O+CO2 ==== CaCO3↓+2HClO
D.氢氧化镁与稀硫酸反应: H+ + OH- ==== H2O
20.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4 B.非金属性:X>Y>Z
C.气态氢化物的稳定性强弱顺序为:HX<H2Y<H3Z
D.元素的最高正价由大到小的顺序为:X<Y<Z
21.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
22.哈伯因发明氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
23.现有如下各说法:
①原子种类由原子核内质子数决定②全部由非金属元素形成的化合物一定为共价化合物③离子键是阳离子、阴离子之间的相互吸引④白磷晶体中,P4之间存在共价键⑤同素异形体在一定条件下的转化为物理变化。上述各种说法正确的是
A.①②⑤正确 B.都不正确
C.④正确,其他不正确 D.仅①不正确
24.在101325Pa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是
A.2H2+O2=2H2O;△H=-484kJ/mol B.H2O(g)=
H2(g)+![]() O2(g);△H=-484kJ/mol
O2(g);△H=-484kJ/mol
C.2H2(g)+ O2(g)=2H2O(l);△H=-484kJ/mol
D.H2(g)+ ![]() O2(g)= H2O(g); △H=-242kJ/mol
O2(g)= H2O(g); △H=-242kJ/mol
25.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
26.下列化学反应在理论上能够设计成原电池的是
A.NaOH+HCl=NaCl+H2O B.CO2在高温下与C化合生成CO
C.2H2O = 2H2+O2 D.2Fe3++Cu=2Fe2++Cu2+
27.已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A、C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ·mol-1
B、C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5518kJ·mol-1
C、C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5518kJ·mol-1
D、C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ·mol-1
28.下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
A.铝的化合物的晶体中不完全是离子晶体 B.表中只有BCl3和干冰是分子晶体 C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
29.据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2=2ZnO ,其原料为锌、空气和电解质溶液,则下列叙述正确的是
A.锌为正极,空气在负极反应 B.负极还原反应,正极氧化反应
C.负极的电极反应为: Zn-2e- + 2OH-== ZnO+H2O D.电池工作时溶液的pH 降低
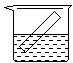
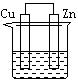
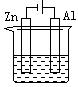 30.下列各装置中都盛有0.1 mol·L—1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是
30.下列各装置中都盛有0.1 mol·L—1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是
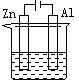
① ② ③ ④
A.③①④② B.①②④③ C.①②③④ D.②①④③
高一化学第二学期期中考试试卷答题卷
第二卷 (共40分)
(请将答案直接填写在第二卷上)
二、实验题(本题1小题,8分)
31.(8分)我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 ,该装置使用的玻璃仪器有______________________________。


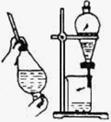
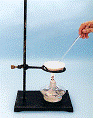
A B C D
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选的试剂是 、 ,鉴定另一种杂质离子的方法是
。
三、填空题(本题包括3小题,共24分)
32.(5分)物质在下列变化过程中克服的是:①分子间作用力 ②共价键 ③离子键。(填序号)
(1)冰融化 ,(2)液溴挥发 ,(3)电解熔融NaCl制Na ,(4)H2S分解生成S和H2 ,(5)碘升华 。
33.(11分)A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
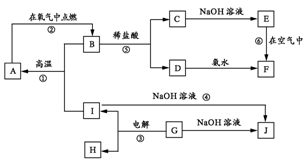
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质B、F、G的化学式:B ,F ,G 。
(3)用文字表述如何用实验加以证明G是离子化合物还是共价化合物:
。
(4) 写出反应①、④的化学方程式:
反应①: 。
反应④: 。
34.(8分) ⑴今有2H2+O2 =2H2O反应,构成燃料电池。
则负极通的应是 ,正极通的应是 。
(2)1991年我国首创以铝、空气和海水电池为能源的新型海水航标灯.它以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就发出耀眼的闪光,其能量比干电池高20~50倍.根据以上叙述,填写这种电池两极的电极反应式:
①负极: .
②正极: .
四、计算题(本题包括1小题,8分)
35.(8分)在一体积固定的密闭容器中加入反应物A、B,发生如下反应:
A + 3B == == 2C 。反应经2min后,A的浓度从开始时的1.20mol·L-1 下降到0.9mol·L-1 ,已知B的起始浓度为1.6mol·L-1。求:(8分)
(1)2min 末B、C的浓度。
(2)以单位时间内B的浓度的减小和C的浓度的增加来表示2min 内该反应的平均速率。
答案
一、选择题(每个小题只有一个选项符合题意,每小题2分,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | B | A | B | C | D | A | C | B | B | C | C | A | C | B |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| B | C | A | A | B | B | D | B | D | D | D | B | B | C | D |
二、实验题(本题1小题,8分)
31、(1)B 烧杯、漏斗、玻璃棒(各2分)
⑵AgNO3溶液 稀HNO3 (各1分)取少量固体与强碱溶液混合加热,生成的气体用湿润的红色石蕊试纸检验(2分)
三、填空题(本题包括3小题,共24分)
32.(5分)(1)① (2)① (3)③ (4)② (5)① (各1分)
33.(11分)Fe (2分)⑵Fe3O4 Fe(OH)3 Al2O3 (各1分)
(3)看其熔融状态是否导电(2分)
(4)8Al+3Fe3O4 = 4Al2O3+9Fe
|
34. (1)氢气,氧气。(2)① Al-3e=Al3+ ②2H2O+O2+4e=4OH-
四、计算题(本题包括1小题,8分)
35.(8分)(1)△C(B)变 =0.9 mol·L-1 △C(C)变 = 0.6mol·L-1
2min 末B的浓度为 1.6mol·L-1 – 0.9mol·L-1 = 0.7mol·L-1
2min 末C的浓度为0.6mol·L-1
(2) ![]()
![]()