金属及其化合物
本卷可能用到的相对原子量:
Na-23 Mg-24 Al-27 Fe-56 Cu-64 H-1 O-16 C-12
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项题意。)
1.下列说法中不正确的是 ( )
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是青铜制品
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
2.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是 ( )
A.制造炊具 B.制防锈油漆 C.制铝合金窗 D.炼铝厂制造铝锭
3.金属钠应存放于① 煤油 ② 石蜡油 ③ 四氯化碳 ④ 密闭容器 ( )
A.①②③ B.②③④ C.①②④ D.①②③④
4.下列4种鉴别碳酸钠和碳酸氢钠的方法中,可靠性最差的是 ( )
A.观察样品外观 B.在少量的样品中滴入几滴水
C.在饱和溶液中滴入几滴酚酞 D.取少量的试样加热
5.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是 ( )
A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
6.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的
A.铜粉 B.铁粉 C.锌粉 D.Fe2(SO4)3
7.下列各组物质的溶液中,分别加入足量氨水,观察到的现象相同的是 ( )
A. FeCl3, AlCl3 B. NaCl, CuCl2 C. MgCl2, AlCl3 D. FeCl2, FeCl3
8.把铁片分别放入下列溶液后,铁片溶解而溶液质量增加,但无气体产生,此溶液是 ( )
A.稀盐酸 B.AgNO3溶液
C.FeCl3溶液 D.Cu(NO3)2溶液
9.下列操作中,溶液的颜色不发生变化的是 ( )
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.铁丝置于氯化铜溶液中一段时间 D.氯化铁溶液中加入还原性铁粉
10.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.NA为阿佛加德罗常数,下述正确的是 ( )
A.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
B.80g硝酸铵含有氮原子数为2NA
C.1L的NaCl溶液中,所含离子总数为2NA
D.标准状况下,22 .4升氦气含有NA个原子数
12.在pH=1的无色溶液中,能够大量共存的离子组是 ( )
A.Mg2+、Fe3+、NO3-、SCN- B.Al3+、Mg2+、Cl-、 SO42-
C.K+、 Na+、Cl-、 HCO3- D.Na+、Ca2+、 NO3-、CO32-
13. 下列说法错误的是 ( )
A.钠是电和热的良导体
B.在水中的溶解性:NaHCO3大于Na2CO3
C.明矾净水是由于明矾在水中形成Al(OH)3胶体具有吸附作用
D.某溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素
14.下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应 Na+2H2O=2Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
15.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A.Cu2+ B.![]() C.Al3+ D.Mg2+
C.Al3+ D.Mg2+
16.在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是: ( )
 A.Mg2+、Al3+、Fe2+
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
金属及其化合物
班别 学号 姓名 成绩
三、填空题(共37分)
17.(11分)写出下列化学反应:(1)-(9)写化学方程式,(10)、(11)写离子方程式。
(1)氧化铝与盐酸
(2)过氧化钠与二氧化碳
(3)加热氢氧化铁
(4)氧化铝与氢氧化钠
(5)硫酸亚铁与氢氧化钠
(6)氢氧化铝与盐酸
(7)氢氧化铝与氢氧化钠
(8)铁与氯化铁
(9)氢氧化亚铁在空气中被氧化
(10)氯化亚铁与氯水
(11)硫酸铝与氨水
18.(7分)取一小块金属钠,用滤纸擦干其表面的煤油,然后加入到FeCl3溶液中,观察实验现象并写出化学方程式:
(1) 试描述钠在溶液中反应的实验现象
(2) 写出化学反应方程式
19.(9分)已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多。A~H各物质的变化关系如下图所示。
 |
(1)写出下列物质的化学式
C E
(2)写出各步反应的化学方程式或离子方程式
反应①的化学方程式
反应④的离子方程式
反应⑤的化学方程式
(3)上述反应中属于氧化还原反应的有
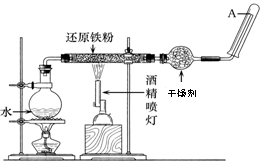 20.(10分)在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
20.(10分)在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式 ;
(2)实验前必须对整套装置进行的操作是 ;
(3)酒精灯和酒精喷灯的点燃顺序是
(4) 试管中收集到的气体是 ,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行 ,检验这一操作的目的是
(5)如果改用排水集气法收集产生的气体,是否还需要用到干燥剂?
,理由是 。
四.(9分)计算题(要求写具体的解题过程、符号要规范)
21、将Na2CO3和NaHCO3混合物19g,充分加热后,收集到CO2有1.12L(标准状况),冷却后将剩余固体溶于水中配成300mL的溶液,求:
(1)原混合物中Na2CO3的质量及NaHCO3物质的量
(2) 配制的溶液的物质的量浓度
金属及其化合物
参考答案
1.B 2.C 3. D 4. D 5.B 6. A 7. D 8. D 9. C 10. D 11.C 12. CD 13. A 14. B 15. C 16. AC
17 (共9分)
(1) FeSO4 (S元素) NH4NO3(N元素) KClO3 (Cl元素) (每项1分)
(2) Fe2(SO4) 3 = 2Fe2+ + 3SO42- Ca(HCO3)2 = Ca2+ + 2HCO3- (每项2分)
(3) Fe3O4 Fe (每项1分)
18.  (14分)
(14分)
⑴ (6分)
⑵ H2和CO2(2分)
Zn + 2H+ = Zn2+ + H2↑置换反应,(3分)
CaCO3 +2H+ == Ca2+ +CO2↑+ H2O 复分解反应(3分)
19.(8分) ⑴KCl,AgNO3。Ag+ + Cl- = AgCl↓
⑵B:Na2SO4 D:Na2CO3
F:Ba(OH)2
20、(6分) OH- 酚酞
CO![]() 盐酸(硝酸)
盐酸(硝酸)
SO42- 氯化钡(硝酸钡)
21.