高一化学秋季期中考试试题
化学试卷
![]() 分值:110分
时间:50分钟
分值:110分
时间:50分钟
注意:请将1——16题答案填入答题卷。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
第Ⅰ卷 (选择题 共60分)
每小题只有一个选项符合题意(5分×12=60分)
1. 下列说法错误的是:
A.原子分子学说的建立,是近代化学发展的里程碑
B.材料是人类赖以生存和发展的物质基础,是人类进步的重要里程碑
C.核能和太阳能的发电装置离不开特殊材料的研制
D.燃料充分燃烧的条件之一是充入尽可能多的空气
2. 判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化
B.电解质非电解质:化合物是否导电
C.强弱电解质:溶液的导电能力大小
D.离子反应:化合物能否拆分
3. 下列说法正确的是
A.化学反应中的能量变化,都表现为热量的变化
B.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
C.寻找合适的催化剂使水分解,同时释放能量,是氢能极有前景的研究方向
D.是吸收能量的反应还是释放能量的反应,可以根据反应物总能量和生成物总能量的相对大小判断
4. 下列叙述错误的是
A.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
B.“温室效应”与化石燃料的燃烧有密切关系
C.将煤进行深加工后再燃烧不如直接燃烧煤效果好
D.燃煤时加入适量石灰石,可减少废气中SO2的量
5. 下列物质中,属于强电解质的是
A.SO2 B.Cu C.CaCO3 D.NaOH溶液
6. 下列电离方程式,错误的是
A.HCl=H++Cl- B.KNO3=K++N5++3O2-
C.BaSO4=Ba2++ SO42- D.Na2CO3=2Na++CO32-
7. 往某无色透明溶液中加入一小块钠,完全反应后没有沉淀生成,该溶液中可能大量存在的离子
组是
A.K+、MnO4-、SO42-、Cl- B.Ba2+、K+、Fe2+、NO3-
C.Na+、NO3-、H+、Cl- D.K+、Mg2+、Cl-、NO3-
8. 下列反应的离子方程式书写正确的是 ( )
A.钾与水反应: K+H2O == K+ +2OH-+H2↑
B.氢氧化钡溶液和稀硫酸反应: Ba2++ SO42-= BaSO4↓
C.少量钠与硫酸铜溶液反应: 2Na+Cu 2+= 2Na++ Cu
D.过量二氧化碳与氢氧化钠溶液反应: CO2+ OH-=HCO3-
9. 下列叙述正确的是
A.锂在氧气中燃烧生成Li2O,但钠和钾在氧气中的燃烧产物是Na2O2和K2O2
B.用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
C.锂、钠、钾均可保存在煤油中
D.钠和钾的熔点都比水的沸点低,钠和钾的合金在室温下呈固态
10.在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、CO32-、OH-等6种离子。已知
甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是:
A.Cu2+、H+、SO42- B.Na+、OH-、CO32-
C.CO32-、OH-、SO42- D.Na+、H+、SO42-
11. 对于氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,已知Cu(IO3)2中I为+5价,CuI的名称是“碘化亚铜”。下列分析正确的是
A.Cu(IO3)2是还原剂,KI是氧化剂,CuI既是氧化产物,又是还原产物
B.Cu(IO3)2被还原, I2既是氧化产物,又是还原产物,CuI是还原产物
C.Cu(IO3)2既是氧化剂,又是还原剂,该反应转移22e-
D.1个Cu(IO3)2在反应中得到12个电子
12. 在一定条件下,PbO2可将Cr3+氧化为Cr2O72-,PbO2还原为Pb2+,则参加反应的Cr3+与PbO2的个数之比为
A.1:3 B.3:1 C.2:3 D. 3: 2
第Ⅱ卷 (非选择题 共50分)
13.(8分)
Cu粉与AgNO3溶液混合,可以发生___________反应(填写基本反应类型)。
⑴上述反应的实质可表示为(写反应方程式):______________________________________;
⑵用双线桥表示该反应电子转移的方向和数目:
14.(13分)
(1) 碳酸氢钠是一种细小的白色晶体,碳酸钠是一种白色粉末,根据它们的性质填空:(填化学式)
①相同温度下,在水中的溶解度:
较大;
②热稳定性:
较稳定;
③与酸反应放出CO2:_________________较剧烈;
④等质量的两种物质与足量盐酸:_________________消耗的盐酸多;
⑤等质量的两种物质与足量盐酸反应生成CO2:_______________生成的多。
(2)请写出除杂所用的试剂以及相应的离子方程式(括号内为杂质):
| 除杂 | 使用试剂 | 离子方程式 |
| ①NaHCO3(Na2CO3)溶液 | ||
| ②CO2(HCl) |
15.(17分)
高一教材中有一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1) 过氧化钠和水反应的离子方程式为:
_______________________________________________,
该反应的还原剂是_____________,一个Na2O2参加反应转移______个电子。
 (2)由实验现象所得出的有关Na2O2和H2O反应的结论是:
(2)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.有氧气生成;
b.______________________________。
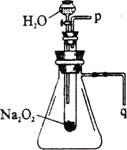
(3)某研究性学习小组拟用右图所示装置进行实验,以证明上述两个结论。其中盛水的仪器叫分液漏斗,与长颈漏斗的不同之处是它的颈部有一个活塞。
①用以验证a的实验操作及现象是:____________________________________________________________________________;
②用以验证b的实验操作及现象是:
____________________________________________________________________________。
(4)往(3)实验的试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液变红,振荡后,红色消褪。为探究此现象,该小组同学从查阅有关资料中得知:Na2O2与H2O反应可生成H2O2。请设计一个简单的实验,证明Na2O2和足量水充分反应后的溶液中有H2O2存在(只需写出实验所用的试剂及观察到的现象)。
试剂:__________________,
现象:___________________________________________。
16.(12分)
(1) Na2O是_________(填“酸性”或“碱性”)氧化物,Na2O2_________(填“也是”或“不是”)。
(2) 在Na2O和Na2O2的混合物中通入过量CO2,固体增重2.06g,同时收集到0.8g O2,求混合物中Na2O的质量。(该小题要有解题过程)
(3)若将(2)中Na2O和Na2O2的混合物溶于足量水,再向其中通入适量CO2,则当NaOH恰好全部转化为Na2CO3时,反应消耗CO2的质量是_____________。
参考答案
单选题(5分×12=60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | A | D | C | C | B | C | D | B | B | B | C |
非选择题(共50分)
13.(8分) 置换(2分)
(1)Cu+2Ag+= Cu2++2Ag(3分)
(2)双线桥分析时,用离子方程式或化学方程式表示均可(3分)
14.(13分)
(1)①Na2CO3(1分) ②Na2CO3(1分) ③NaHCO3(1分) ④Na2CO3(2分) ⑤NaHCO3(2分)
(2)
| 除杂 | 加入试剂 | 离子方程式 |
| ① | 过量的CO2(1分) | CO2+CO32-+H2O==2HCO3-(2分) |
| ② | 饱和NaHCO3溶液(1分) | HCO3-+H+===CO2↑+H2O(2分) |
15. (17分)
(1)2Na2O2+2H2O==4Na++4OH-+O2↑(3分) 过氧化钠(1分) 1(1分)
(2)该反应为放热反应(2分)
(3)打开分液漏斗活塞,将带火星的木条靠近导管口(p处);木条复燃(3分)
将导管口(q处)浸入水中,打开分液漏斗活塞;导管口有气泡冒出(3分)
(4)二氧化锰(2分) 有使带火星木条复燃的气体生成 (2分)
(或其它合理答案)
16.(12分)
(1)碱性(1分) 不是(1分)。
(2)0.93g(6分)
(3)2.86g(4分)