高二化学下学期期末模拟试题
答题所需相对原子质量:H:1 C:12 O:16 Si:28 S:32 Cl:35.5 Na:23 Ba:137
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
 1.2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
1.2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5反应冶炼钒,铝作还原剂
D.V原子序数为23,该原子的价电子构型为4S24P1
2.化学反应N2+3H2 = 2NH3的能量变化如题13图所示,该反应的热化学方程式是
 A.N2(g)+3H2(g) = 2NH3(l);
A.N2(g)+3H2(g) = 2NH3(l);
⊿H = 2(a—b—c)kJ/mol
B.N2(g)+3H2(g) = 2NH3(g) ;
⊿H = 2(b—a)kJ/mol
C.![]() N2(g)+
N2(g)+![]() H2(g) = NH3(l) ;
H2(g) = NH3(l) ;
⊿H = (b+c—a)kJ/mol
D.![]() N2(g)+
N2(g)+![]() H2(g) =NH3(g) ;
H2(g) =NH3(g) ;
⊿H = (a+b)kJ/mol
3.已知:4NH3(g)+5O2(g) = 4NO(g)+6H2O(g),△H=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
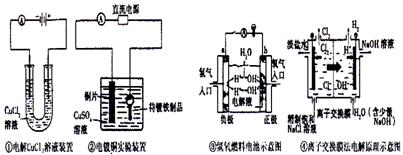
4.关于下列电化学装置图的说法,正确的是
|
A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
5.水是一种弱电解质,在纯水及稀溶液中,水的电离过程为2H2O![]() 2H++2OH-,则下列叙述正确的是
2H++2OH-,则下列叙述正确的是
A.c(H+)随着温度升高而降低 B.水的电离度α(400C)>α(200C)
C.离子积Kw(500C)<Kw(350C) D.在某温度时纯水中c(H+)=10-6mol·L-1,此时pH=6的溶液显酸性
6.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
7.下列说法正确的是(NA为阿伏加德罗常数)
A.58.5g氯化钠晶体中含有NA个氯化钠分子 B.106g无水碳酸钠固体中阴阳离子总数大于3NA
C.标准状况下,22.4LC2H4的分子中含有5NA个σ键和NA个π键
D.60gSiO2中含Si—O键的个数为2NA
8.下列说法中正确的是
A.原子间通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度
B.P4和CH4都是正四面体形分子且键角都为109o28ˊ
C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
D.NO2、SO2、BF3、NCl3分子中没有一个分子中原子最外层电子都满足了8e-稳定结构
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9. 下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
![]() H2↑+ Cl2↑
H2↑+ Cl2↑
B.碳酸镁悬浊液中加醋酸 CO32—+2CH3COOH = 2CH3COO—+CO2↑+H2O
C.明矾溶液与小苏打溶液混合 Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.氯气通入冷水中 Cl2+H2O = Cl—+HClO+H+
10.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
 有关该电池的说法正确的是
有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
11.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
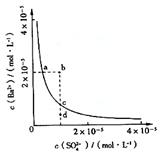
12.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
提示:BaSO4(s) ![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
13.冰是立方面心结构。下列是碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排列),其中与冰的晶体结构类型相同的是
A.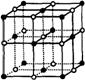 B.
B.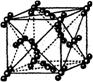 C.
C.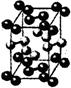 D.
D.
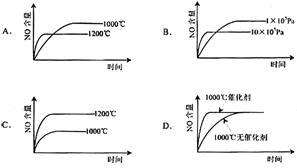
14.如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
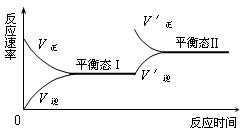
A.反应达平衡时,正反应速率和逆反应速率相等
B.若反应为A(g)+B(g)![]() C(s),则平衡移动的原因是增大压强
C(s),则平衡移动的原因是增大压强
C.由图像关系可以判断,正反应为吸热反应
D.由平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1=K2
三、(本题1小题,共12分)
15、(12分)某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
⑴ 甲同学运用沉淀法测定样品中NaOH的含量。甲同学选用的药品除样品外,还应有 ;实验中应测定的数据有 。
⑵ 乙同学运用滴定法测定样品中NaOH的含量。
① 用分析天平准确称取该样品5.00g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应 。
② 用浓度为0.1000mol/L的盐酸标准溶液进行滴定。开始滴定前的一步操作是 。
③ 滴定过程中用 测定锥形瓶中溶液的pH,临近滴定终点时测定pH应 。
④ 滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在答题卡上的坐标图中绘制出上述中和滴定的曲线。
⑤ 下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中应选用的指示剂是 。
| 指示剂 | 变色范围 (pH) | 颜色 | |
| 酸色 | 碱色 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
⑥ 样品中,NaOH的质量百分含量为 。
四、(本题包括2小题,共18分)
16.(8分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的电子排布式 。
⑵写出C单质与水反应的化学方程式 。
A与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
⑶D元素最高价氧化物晶体的硬度 (填“大”、“小”),其理由是 。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
17.(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
五、(本题1小题,共10分)
18.(10分)日常生活中使用铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
 |
一些氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为 。
(2)实验室进行步骤②③④的操作名称为 。
(3)固体A的化学式为 ,物质C的化学式为 ;溶液中的Na+、Ca2+、Mg2+是在步骤 中除去的。
(4)步骤③调节pH的数值范围为 ,步骤④调节pH的数值范围为 。
 (5)步骤⑥反应的化学方程式为:
。
(5)步骤⑥反应的化学方程式为:
。
六、(本题1小题,共10分)
19.(10分)
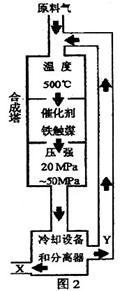
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图2所示。
①X的化学式为 ;
②据图2中分析,下列说法正确的是(选填字母序号) ;
A.在此温度下,可提高原料的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制,选择此条件下压强
D.为提高原料的转化率,采用循环操作
(2)常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水电离出的c(OH—) 10—7mol/L(填写“>”、“<”或“=”);
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为 。
③ 若该溶液是由体积相等的盐酸和氨水混合而成,且恰好呈中性,则混合前c (HCl)
c (NH3·H2O)(大于、小于或等于,下同),混合前酸中c (H+)和碱中c(OH-)的关系c(H+) c(OH-),混合后溶液中离子浓度大小关系为 。
七、(本题1小题,共10分)
20.(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
八、(本题1小题,共12分)
21.(12分)
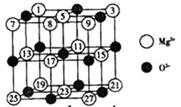
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如右图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
![]() 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
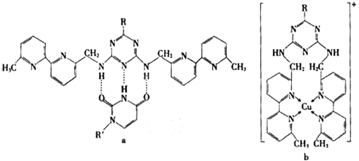
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
。
答题卷
选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
非选择题:
15.(12分)
⑴甲同学选用的药品除样品外,还应有 ;实验中应测定的数据有 。
⑵ 乙同学运用滴定法测定样品中NaOH的含量。
①滴定管在使用前除洗涤外,还应 。
②开始滴定前的一步操作是 。
③ 滴定过程中用 测定锥形瓶中溶液的pH,临近滴定终点时测定pH应 。
④请在坐标图中绘制出上述中和滴定的曲线。
⑤中和滴定中应选用的指示剂是 。
⑥ 样品中,NaOH的质量百分含量为 。
16.(8分)
(1)加入盐酸时,氧化铝发生反应的离子方程式为 。
(2)实验室进行步骤②③④的操作名称为 。
(3)固体A的化学式为 ,物质C的化学式为 ;溶液中的Na+、Ca2+、Mg2+是在步骤 中除去的。
(4)步骤③调节pH的数值范围为 ,步骤④调节pH的数值范围为 。
(5)步骤⑥反应的化学方程式为: 。
17.(10分)
(1)平衡状态的标志是 。(填字母)(2)措施可行的是 。(填字母)
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
18.(10分)
(1)氧化铝发生反应的离子方程式为 。
(2)步骤②③④的操作名称为 。
(3)固体A的化学式为 ,物质C的化学式为 ;溶液中的Na+、Ca2+、Mg2+是在步骤 中除去的。
(4)步骤③调节pH的数值范围为 ,步骤④调节pH的数值范围为 。
(5)步骤⑥反应的化学方程式为: 。
19.(10分)
(1)
①X的化学式为 ;②说法正确的是(选填字母序号) ;
(2)
① 氨水中水电离出的c(OH—) 10—7mol/L(填写“>”、“<”或“=”);
②溶液中离子浓度由大到小依次为 。
③混合前c (HCl) c (NH3·H2O)(大于、小于或等于,下同),混合前酸中c (H+)和碱中c(OH-)的关系c(H+) c(OH-),混合后溶液中离子浓度大小关系为 。
20.(10分)
(1)C原子的电子排布式为 , A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
21.(12分)
(1)其主要作用除了降低熔点之外还有 。
(2)请改正图中错误: 。
(3)请用原子结构的知识解释发光的原因: 。
(4)解释表中氟化物熔点差异的原因: 。
(5)①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
。
选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| C | A | C | D | B | C | C |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| A | CD | A | AC | C | BC | BC |
15.(本题共12分)
⑴ MgCl2溶液 样品质量和加入足量
MgCl2溶液后生成的沉淀质量
⑵ ① 检漏 ② 调节盛标准液滴定管
的液面于“0”刻度以下
③ pH计 每滴一滴测一次
④ (滴定曲线如右)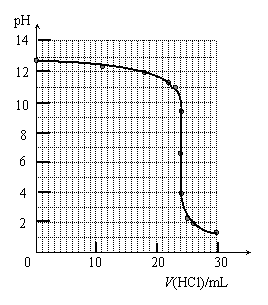 ⑤ 甲基橙或酚酞
⑤ 甲基橙或酚酞
⑥ 96%
16.(本题共8分)
⑴第三周期 ⅦA 1s22s22p63s23p4 ⑵2Na+2H2O=2NaOH+H2↑ 大于
⑶大 SiO2是原子晶体 或 小 CO2是分子晶体 (合理即给分)
⑷Cl 高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强(合理即给分)
17.(10分)
(1)bc (2)b
(3)消耗的O2物质的量:![]()
生成的SO3物质的量:![]()
SO2和SO3的物质的量和:![]()
反应前的SO2物质的量:![]()
SO2的转化率:![]()
(4)在给定的条件下,溶液呈强酸性,BaSO3不会沉淀。因此BaSO4的质量![]()
18.(10分)(1)(2分)Al2O3+6H+==2Al3++3H2O (2)(1分)过滤
(3)(3分)SiO2 NaOH溶液[或Ca(OH)2溶液] ④
|
5.2<pH<10.4 (或6<pH<10)
(5)(2分)2Al2O3(熔融)====4Al+3O2↑
19.(1)①NH3 (1分) ②BCD (2分)
(2) ①小于 (1分) ②c(Cl—)>c(NH4+)>c(H+)>c(OH—)(2分)
③ 小于 (1分) 大于 (1分) c(Cl—)=c(NH4+)>c(H+)=c(OH—)(2分)
20.(9分)(1) 1s22s22p4 (2分) σ(1分)
(2)二(1分) IVA (1分) 非极性(1分) 原子(1分)
(3) O>P>Si>Li(2分)
21题(12分)
(1) 以MgCl2为原料用熔融盐电解法制备Mg时,常加入NaCl、KCl、或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有:增大离子浓度,从而增大熔融盐的导电性。
(2) 请更正图中错误:⑧应为黑色。
(3) 请用原子结构的知识解释发光的原因:原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从内侧轨道跃迁到外侧的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来轨道,并向外界释放能量(光能)。
(4) 解释表中氟化物熔点差异的原因:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF。
(5) ①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有:σ键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用的差异:a中微粒间的相互作用为氢键,b中微粒间的相互作用为配位共价键。