高二化学第二学期第二次质量检测
高二化学(选修)
时间:100分钟 满分:120分
第一卷(选择题 共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.下列叙述正确的是
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中,都不存在单个小分子
D.甲烷的分子是对称的平面结构,所以是非极性分子
2.在pH =1的无色溶液中,能大量共存的是:
A.Al3+ 、Na+、NO3—、Cl— B.Cu2+ 、Na+、NO3—、Cl—
C.Ba2+、K+、CO32—、MnO4— D.NH4+ 、H+ 、CH3COO—、 OH—
3. 在下面的电子结构中,第一电离能最小的原子可能是
A.ns2np3 B. ns2np5 C.ns2np4 D.ns2np6
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
5.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
![]() 6. 可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温恒容下已达到平衡的是
6. 可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温恒容下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
7.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) ![]() 2HBr(g)
2HBr(g) ![]() 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b. a与b的关系是
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b. a与b的关系是
 A. a>b B.
a=b C. a<b D.无法确定
A. a>b B.
a=b C. a<b D.无法确定
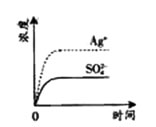
8.已知Ag2SO4的KW 为2.0×10—3,将适量Ag2SO4固体溶于100 mL 水中至刚好饱和,该过程中Ag+和SO42—浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L—1)。若t1时刻在上述体系中加入100 mL 0.020 mol·L—1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42—浓度随时间变化关系的是
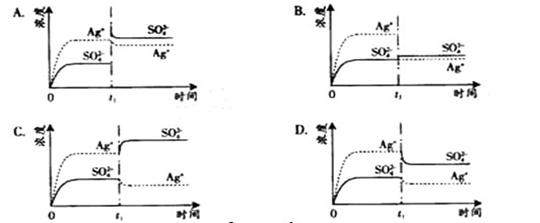
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9.下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2: NH3·H2O+CO2=NH4++HCO3—
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO—=CaSO3![]() +2HClO
+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S![]()
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH—+H++ SO42=CaSO4![]() +H2O
+H2O
10.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH—) + c(A—)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO—) +2c(OH—) == 2c(H+) + c(CH3COOH)
D.0.1mol·L—1的NaHA溶液,其pH=4:c(HA—)>c(H+)>c(H2A)>c(A2—)
11.元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
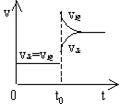 12.往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g) +I2(g)
12.往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g) +I2(g) ![]() 2HI(g)
2HI(g)
(⊿H<0),当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
A.平衡不移动,混合气体密度增大
B.容器内气体颜色变深,平均相对分子质量不变
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象为右图
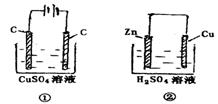 13.下图两个装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol·
13.下图两个装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol·![]() ,工作一段时间后,测得导线上都通过了0.02 mol
,工作一段时间后,测得导线上都通过了0.02 mol![]() ,若不考虑溶液体积的变化,则下列叙正确的是
,若不考虑溶液体积的变化,则下列叙正确的是
A.产生气体体积:①=②
B.电极上析出固体质量:①<②
C.溶液的pH变化:①减小;②增大
D.电极反应式:①中阳极: ![]()
②中负极: ![]()
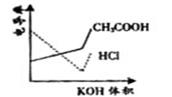 14.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
14.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 |
第二卷(非选择题 共72分)
三、(本题包括2小题,共12分)
15. (6分)写出298K时,下列反应的热化学方程式:
⑴用CO(g)还原1mol Fe2O3(s), 生成CO2(g)和Fe(s)放热24.8 KJ.
.
⑵ 2g H2(g)和适量的O2(g)充分反应生成液态水,放出热量285.8KJ.
.
16. (6分)将气体A、B置于容积为2L的密闭容器,发生如下反应:
4A(g)+B(g)![]() 2C(g)反应进行到10S末达到平衡状态时:测得容器内有A为0.6mol,B为0.4mol,C为0.2mol,
2C(g)反应进行到10S末达到平衡状态时:测得容器内有A为0.6mol,B为0.4mol,C为0.2mol,
(1)则vA= _____________ vB= _________________ vC= ______________
(2)反应前A有 ___ mol,反应前B有 _____ mol
⑶达到平衡状态时,A物质的转化率为 。
四、(本题包括2小题,共22分)
17.(10分)原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响。试回答:
⑴ BF3分子的立体结构为 形,NF3 分子的立体结构为 形;
⑵ 碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式) ,存在一个π键的分子是(写名称) ;
⑶ H2O、NH3、CH4分子中键角由大到小的顺序为 ________________ ,原因是 ____________________ ;
⑷ 由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越大、阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。据此,四种卤化银在水中的溶解度由大到小的顺序为 __________________________ 。
18.(12分)氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3—的存在,基态N3—的电子排布式为 。
⑵N≡N的键能为942 kJ·mol—1,N-N单键的键能为247 kJ·mol—1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4—可形成离子液体。离子液体由阴、阳离子组成,熔点低100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作
 (填代号)
(填代号)
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
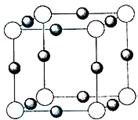
⑷X+中所有电子正好充满KLM三个电子层,它与N3—形成的晶体结构如图所示。X的元素符号是 ,与同一个N3—相连的X+有 个。
五、(本题包括2小题,共18分)
19.(12分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_______、_______; 杂化轨道分别是________、_________;a分子的立体结构是___________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体:
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________;
(4)Y与Z比较,电负性较大的_________,
Z的+2价离子的核外电子排布式是_______________________。
20.(6分)在相同条件下进行锌与盐酸、醋酸溶液反应的对照实验,相关数据如下:
| Zn | 酸 的 用 量 | 反 应 速 率 | 产生H2的总量 | |
| Ⅰ | 1.3g | 100mL0.2mol/L盐酸 | υ1 | n1 |
| Ⅱ | 1.3g | 100mL0.2mol/L醋酸溶液 | υ2 | n2 |
| Ⅲ | 1.3g | 100mLc(H+)=0.20mol/L CH3COOH | υ3 | n3 |
试比较有关量的大小:
(1)开始反应时速率υ1、υ2、υ3三者的关系: 填(“>”、“<”、“=”,下同)。
(2)产生H2的总量n1 、n2 、n3三者的关系 。
(3)反应开始后一段时间内(反应均未结束)反应速率υ1 υ3。
六、(本题包括2小题,共20分)
21.(8分)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子间可以形成链状结构,氮原子间也可形成链状结构,假设氮、氢原子间只以N-N键或N-H键形式连接,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的NH3对农业、化学和国防工业具有重要意义。其合成原理是:
![]() N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
①在一定温度下,将1molN2和4molH2气体通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内的压强为起始时的80%。此时反应放出的热量为 。
②保持温度不变,在相同的容器中,将起始时刻物质的量设为amolN2、bmolH2和cmolNH3,欲使平衡时NH3的物质的量分数为25%,则
I.达到平衡时,①与②放出的热量 (填字母)
A.一定相等 B.前者一定小于后者
C.前者等于或小于后者 D.前者等于或大于后者
II.若该反应正向进行,则a的取值范围是 。
22、(12分)在25mL 0.1mol·L-1 盐酸溶液中滴入0.2mol·L-1 NaOH溶液,以酚酞为指示剂。
(1)填写下表中所有空格:(计算结果保留一位小数)
| ①加入NaOH溶液的体积(mL) | 5.0 | 7.5 | 10.7 | 12.0 | 12.3 | a | 12.8 | 13.0 | b | 17.5 | 20.0 |
| ②溶液pH | 1.3 | 1.5 | 2.0 | 2.6 | 3.0 | 7.0 | 11.2 | 11.4 | 12.0 | 12.4 | 12.5 |
| ③指示剂的颜色 | 无 | 无 | 无 | 无 | 无 | 粉红 | 红 | 红 | 红 | 红 | 红 |
a mL 、 b mL
(2)根据上表中的数据,在下图格纸中,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。(坐标中pH变化及体积变化要标明)
|
0 5 10 15 20
(3)在实验中,必不可少的玻璃仪器是________________________ _____。
(4)进行中和滴定操作时,眼睛注视__ _
滴定终点的判断依据是__________________________________。
(5)在操作中,锥形瓶用蒸馏水洗净后,未经干燥即进行滴定造成测定结果 _____________填(“偏高”、“偏低”、“无影响”)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | A | C | B | D | C | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 | A | AC | B | BD | C | D |
15.⑴ 3CO(g) + Fe2O3(s)== 2Fe (s)+ 3CO2(g) △H == - 24.8KJ/mol
⑵ H2(g) +1/2 O2(g) == H2O(l) △H == - 285.8KJ/mol
16.⑴ V(A) == 0.02 mol/l·s V(B) == 0.005mol/L·s V(C)== 0.01mol/L·s
⑵ A有 1mol ; B有 0.5 mol
⑶ A的转化率为: 40%
17.⑴ 平面三角 三角锥
⑵ CH3CH3 乙烯
⑶ CH4>NH3>H2O 由于NH3分子中有1对孤对电子,H2O分子有2对孤对电子,对成键电子对的排斥作用增大,故键角逐渐减小。
⑷ AgF>AgCl>AgBr>AgI
18.答案:⑴1s22s22p6;⑵π σ;⑶小 b;⑷Cu 6
19.⑴CH4,SiH4;sp3,sp3;正四面体⑵分子,原子;⑶CO2;⑷C ,1s22s22p63S23P63d10
20.(1)υ3=υ1>υ2= ⑵n3>n1 = n2 、 ⑶< <
21.(8分)(1)NmHm+2(m为正整数)
(2) ① 46kJ;②I.D;II.0.5<a≤1
22、(12分) (1) 12.5 、 b 14.5(14.47) (各1分)。
|
0 5 10 15 20
(3)酸式滴定管 碱式滴定管 锥形瓶(3分)
(4)锥形瓶中溶液颜色的变化(1分),溶液由无色变为粉红色(或浅红) (1分)
,且半分钟内不变色. (1分)
(5)“无影响” (2分)