高二化学下学期期末模拟试卷
第一卷(选择题 共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的
A.正极反应式为:O2+2H2O+4e-=4OH―
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
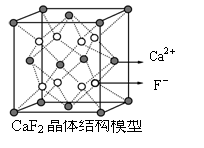 2、下列关于晶体的说法正确的是
2、下列关于晶体的说法正确的是
A.离子晶体中一定不含共价键
B.金属晶体的熔点一定比原子晶体低、一定比分子晶体高
C.CaF2晶体中与一个Ca2+距离最近且距离相等F-的有4个
D.SiO2晶体中每个Si原子与四个O原子以单键相结合
3、取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为
 A.0.01mol/L B.
0.017mol/L C. 0.05mol/L D. 0.50mol/L
A.0.01mol/L B.
0.017mol/L C. 0.05mol/L D. 0.50mol/L
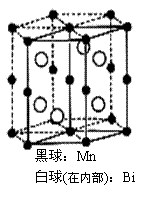
4. 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光 盘驱动器,它使用磁光盘片作存储媒体。磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。下图是该物质的晶体结构,其化学式可表示为
A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3
5.下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
6、对已经达到化学平衡的下列反应:2X(g) +Y(g) ![]() 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动;
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动;
C.正、逆反应速率都减小,平衡向逆反应方向移动;
D.正、逆反应速率都增大,平衡向正反应方向移动;
![]()
![]()
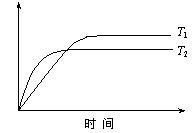 7.在密闭容器中进行如下反应:H2(g)
+I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
7.在密闭容器中进行如下反应:H2(g)
+I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
8、下列各组离子在给定条件下能大量共存的是
A、在pH=1溶液中:NH4+、K+、ClO—、Cl—
B、有SO42—存在的溶液中:Na+、Mg2+、Ca2+、I—
C、有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br—
D、在c(H+) =1.0×10—13mol/L的溶液中:Na+、S2—、AlO2—、SO32—
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9.能正确表示下列反应的离子方程式是
A.足量硫酸铝与纯碱反应:![]()
B.硫酸铜与烧碱反应:![]()
C.苯酚与碳酸钠反应:![]()
D.碳酸钡与硫酸反应:![]()
10.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-,得m-a=n+b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
11.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)< c(NH4+)
B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
12.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L![]() min)
min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
13.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在②实验后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
④取③实验后的上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验判断,以下推测正确的是
A. 一定有SO32-离子 B. 一定有HCO3-离子
C. 不能确定CO32-离子是否存在 D. 不能确定Cl-离子是否存在
14.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
![]()
![]()
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 |
第二卷(非选择题 共72分)
三、(本题包括3小题,共18分)
15.(6分)有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1) 溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3) 取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4) 将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5) 另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:
在该溶液中肯定存在的离子是_________________________,肯定不存在的离子是____________________,不能确定是否存在的离子是_________________________。
16.(6分)在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了12g的气体,
(1) 铜锌原电池的总反应的离子方程式为:___________________________________________________________________
(2) 铜电极产生12g气体的过程中有 克的锌溶解。
(3) 铜电极产生12g气体的过程中有 摩尔的电子发生了转移。
17、(6分)发射卫星时可用肼(N2H4)为燃料,用NO2作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ·mol-1
(1)写出肼和二氧化氮反应的热化学方程式 。
(2)又知1mol液态水气化时需吸收44kJ的热量,则16g肼和二氧化氮完全反应生成液态水时放出的热量为 kJ。
四、(本题包括2小题,共24分)
18.(12分) X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
19.(12分)在一定温度下,向一个容积不变的密闭容器中加人 2 molA 和 2 molB ,发生反应:2A ( g ) + B ( g )![]() 3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
(1)ω1% ω2 % (填“ > ”、“=”或“ < " )。
(2)b c (填“ > ”、“=”或“ < ”或“不确定”)。
(3)a 、 b 、c三者的数学关系为 (用不等式或等式表示)。
(4)若A、B、C的起始加入量分别为xmol、ymol、zmol,达平衡时B的体积分数仍为ω1%,则x、y、z应满足的关系是 ,设第一次达到平衡时A的物质的量为n,则现状况下达到平衡时A的物质的量为 mol(用n、x、z表示)。
五、(本题包括2小题,共22分)
20.(12分)已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。
请回答下列问题:
(1)该溶液中的溶质可能有三种情况。分别为(填化学式)
① ,② , ③ ;
(2)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(可能有多种情况,只写出两种即可):
① ,
② ;
(3)当溶液中各离子浓度大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),该溶液可能是 (填序号)。
A. 由0.1mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合而成
B. 由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的NaOH溶液等体积混合而成
C. 由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的CH3COOH溶液等体积混合而成
21(10分)、实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数__________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 ______________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察______________。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由___________色变成_________色。
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为_________。
六.计算题(本题包括小题,共8分)
 22、(8分)已知:在某温度下,可逆反应X(g)+Y(g)
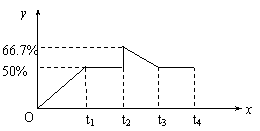
22、(8分)已知:在某温度下,可逆反应X(g)+Y(g) ![]() 2Z(g)的平衡常数为4。在该温度下,向某恒容密闭容器中加入2 mol X和2 mol Y,在t1时刻达到平衡,在t2时刻再向此容器中加入2 mol Z,在t3时刻反应重新达到平衡至t4时刻,通过计算画出0~t4时间段内混合气中Z的体积分数(y坐标)随时间(x坐标)变化曲线。(要有计算过程)
2Z(g)的平衡常数为4。在该温度下,向某恒容密闭容器中加入2 mol X和2 mol Y,在t1时刻达到平衡,在t2时刻再向此容器中加入2 mol Z,在t3时刻反应重新达到平衡至t4时刻,通过计算画出0~t4时间段内混合气中Z的体积分数(y坐标)随时间(x坐标)变化曲线。(要有计算过程)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | D | C | B | A | C | D | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 | A | AB | AC | D | D | C |
15. Fe3+、NO3-、Al3+、SO42-;
HCO3-、Ba2+、Fe2+;
NH4+、C1-
16.(1)Zn +2H+ = Zn2++H2 ↑ (2)65g (3)2mol
17、
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ·mol-1
(2)327.93
18.(1)S C
(2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr 四 1s22s22p63s23p63d54s1 +6
(4)F-H…F F-H…O O-H…F O-H…O
19.(1) == ; (2) 不确定;
(3)a = b + c (4) Y = X + Z/3 (X + 2Z/3)n/2
20.(1)①CH3COONa②CH3COONa和NaOH③CH3COONa和CH3COOH
(2)①c(Na+)>c(CH3COO-)>c(HO-)>c(H+)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(3)C
21、(10分)①偏高 ②无影响 ③B ④无 粉红(或浅红)
(2)18.85%
22、
 设该密闭容器的体积为V L,第一次平衡时(即t1时刻),有a mol 的X转化为Z。
设该密闭容器的体积为V L,第一次平衡时(即t1时刻),有a mol 的X转化为Z。
X(g) + Y(g) ![]() 2Z(g)
2Z(g)
开始时: 2 2 0
变化量: a a 2 a
平衡时:2-a 2-a 2 a
则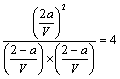 (2分) [若写作
(2分) [若写作![]() 不得分]
不得分]
解之得:a=1 第一次平衡时Z的体积分数为50%(1分)
t2时刻,Z%=![]() ×100%=66.7%(1分)
×100%=66.7%(1分)
由于反应前后气体的分子数不变,所以加入2mol Z重新达到平衡时,Z的体积分数与第一次平衡时相同 ,即为50%(2分)
(作图正确得3分)